某反应体系中有物质:Bi2(SO4)3 NaMnO4 H2O MnSO4 NaBiO3 Na2SO4
| 某反应体系中有物质:Bi2(SO4)3、NaMnO4、H2O、MnSO4、NaBiO3、Na2SO4、H2SO4. (1)请将NaBiO3之外的反应物与生成物分别填入以下空格内.  (2)反应中,被氧化的元素是______,氧化剂是______. (3)将氧化剂与还原剂及其已配平的化学计量数填入下列空格中,并标出电子转移的方向和数目. 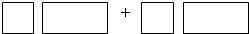 |
参考解答
| (1)该反应中NaBiO3是反应物,根据Bi元素守恒,Bi2(SO4)3是生成物,Bi元素由反应物到生成物,化合价降低,所以NaBiO3是氧化剂;NaMnO4中锰元素的化合价是+7价,MnSO4中锰元素的化合价是+2价,要选取还原剂,只能是化合价由低变高,所以MnSO4作还原剂,NaMnO4是氧化产物;再根据元素守恒,反应物中还有硫酸,产物中还有Na2SO4和H2O. 故答案为:NaBiO3+MnSO4+H2SO4→Bi2(SO4)3+NaMnO4+Na2SO4+H2O. (2)该反应中,锰元素由+2价失电子变为+7价,所以二价锰元素被氧化;通过(1)分析知,NaBiO3是氧化剂. 故答案为:正二价的锰元素; NaBiO3. (3)该反应中,NaBiO3是氧化剂,MnSO4作还原剂;MnSO4→NaMnO4,锰元素由+2价→+7价,一个MnSO4失去5个电子;NaBiO3→Bi2(SO4)3,Bi元素由+5价→+3价,生成一个Bi2(SO4)3,需得4个电子,所以其得失电子的最小公倍数为20. 故答案为:  |
相似问题
下列表示反应中电子转移的方向和数目正确的是[ ]A.B.C.D.
下列表示反应中电子转移的方向和数目正确的是[ ]A B C D
高温下用碳还原某金属氧化物MO2 在标准状况下 得到400mLCO 100mLCO2和0.978g金
高温下用碳还原某金属氧化物MO2,在标准状况下,得到400mLCO、100mLCO2和0 978g金属M,则M的相对原子质量为()A.40B.73 C.118D.207
(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾) 溶液会发如下反应:Mn2++S2
(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发如下反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+,该反应常用于检验Mn2+的存在.其特征现
浓硝酸和铜反应的化学方程式如下: Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O(
浓硝酸和铜反应的化学方程式如下: Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O(1)指出该氧化还原反应的氧化剂和还原剂,并标出电子转移的方向和数目(在上面
分析下列氧化还原反应中化合价变化的关系 标出电子转移的方向和数目。 (l)2KNO32KNO2+O2
分析下列氧化还原反应中化合价变化的关系,标出电子转移的方向和数目。 (l)2KNO32KNO2+O2↑____________; (2)Fe+H2SO4==FeSO4+H2↑______________;(3












