(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾) 溶液会发如下反应:Mn2++S2
| (1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发如下反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+,该反应常用于检验Mn2+的存在.其特征现象是______.若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量______mol. (2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有______. (3)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应: ______NaBiO3+______MnSO4+______H2SO4→______Na2SO4+______Bi2(SO4)3+______NaMnO4+______H2O ①配平上述反应的化学方程式,并标出电子转移的方向和数目; ②上述反应中还原产物是______. |
参考解答
| (1)由反应可知生成MnO4-,溶液由无色变为紫色;Mn元素化合价由+2价升高为+7价,共升高5价,O元素化合价由-1价降低为-2价,2个O共降低2价,故0.1mol还原剂参加反应,消耗氧化剂的物质的量为0.1×5÷2=0.25mol, 故答案为:溶液由无色变为紫色,0.25mol; (2)过硫酸钾具有强氧化性,可以把Cl-氧化为氯气, 故答案为:氯气; (3)①反应中NaBiO3→Bi2(SO4)3,Bi元素化合价由+5价降低为+3价,共降低4价,MnSO4→NaMnO4,Mn元素化合价由+2价升高为+7价,共升高5价,化合价升降最小公倍数为20,故Bi2(SO4)3系数为5,MnSO4系数为4,根据元素守恒可知,NaBiO3的系数为10,NaMnO4系数为4,根据钠元素守恒可知Na2SO4的系数为3,根据硫酸根守恒可知H2SO4的系数为14,根据氢元素守恒可知H2O的系数为14,配平反应的化学方程式,标出电子转移的方向和数目为: 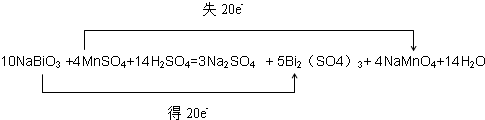 , ,故答案为:10、4、14、3、5、4、14,  ; ;②反应中NaBiO3→Bi2(SO4)3,Bi元素化合价由+5价降低为+3价,所以Bi2(SO4)3是还原产物, 故答案为:Bi2(SO4)3. |
相似问题
浓硝酸和铜反应的化学方程式如下: Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O(
浓硝酸和铜反应的化学方程式如下: Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O(1)指出该氧化还原反应的氧化剂和还原剂,并标出电子转移的方向和数目(在上面
分析下列氧化还原反应中化合价变化的关系 标出电子转移的方向和数目。 (l)2KNO32KNO2+O2
分析下列氧化还原反应中化合价变化的关系,标出电子转移的方向和数目。 (l)2KNO32KNO2+O2↑____________; (2)Fe+H2SO4==FeSO4+H2↑______________;(3
Na2FeO4是一种高效多功能水处理剂 既能消毒杀菌 又能除去悬浮物杂质。一种制备Na2FeO4的反
Na2FeO4是一种高效多功能水处理剂,既能消毒杀菌,又能除去悬浮物杂质。一种制备Na2FeO4的反应原理为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,下
已知M2O7x-+3S2-+14H+=2M3++3S↓+7H2O 则M2O7x-中M的化合价为A.+
已知M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-中M的化合价为A.+2B.+3C.+4D.+6
按要求书写化学反应方程式 是氧化还原反应的用单线桥标出电子转移的方向和数目(1)铁和水蒸气的反应__
按要求书写化学反应方程式,是氧化还原反应的用单线桥标出电子转移的方向和数目(1)铁和水蒸气的反应_______________________ (2)加热小苏打固体____












