稀HNO3和锌反应的化学方程式如下:4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O(1
| 稀HNO3和锌反应的化学方程式如下:4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O (1)请双线桥标明上述化学方程式中电子转移的方向和数目______. (2)该反应中还原剂是______,还原产物是______,每2mol Zn参加反应,转移的电子______个. (3)上述反应中,HNO3没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸与总硝酸的物质的量之比是______. |
参考解答
(1)在反应4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O中,Zn元素化合价升高,由0价升高为+2价,失去电子,N元素化合价降低,由+5价降低为+1价,得到电子,电子转移的方向和数目可表示为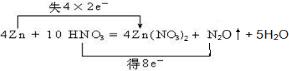 , 故答案为:  ; (2)由化合价变化可知还原剂为Zn,N2O为还原产物,每2mol Zn参加反应,转移的电子为4NA, 故答案为:Zn;N2O;4NA; (3)由化合价变化可知10mol硝酸参加反应,只有2mol被还原,则没有参加氧化还原反应的硝酸与总硝酸的物质的量之比是4:5,故答案为:4:5. |
相似问题
对于Fe+2HCl=FeCl2+H2↑反应 下列说法不正确的是( )A.Fe是还原剂 被氧化B.H
对于Fe+2HCl=FeCl2+H2↑反应,下列说法不正确的是( )A.Fe是还原剂,被氧化B.HCl是氧化剂,发生了还原反应C.-1价氯在反应中价态未变,所以HCl既不
需要加入还原剂才能实现的变化是( )A.MnO2→MnO4-B.A1O2-→Al(OH)3C.As
需要加入还原剂才能实现的变化是( )A.MnO2→MnO4-B.A1O2-→Al(OH)3C.AsO43-→AsO33-D.Cl-→Cl2
Ⅰ.某一反应体系有反应物和生成物共五种物质:O2 H2CrO4 Cr(OH)3 H2O H2O2.已
Ⅰ.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2.已知该反应中H2O2只发生如下过程:H2O2→O2.(1)该反应中的还原剂是
在NO2与水的反应中( )A.氮元素的化合价不发生变化B.NO2只是氧化剂C.NO2只是还原剂D.
在NO2与水的反应中( )A.氮元素的化合价不发生变化B.NO2只是氧化剂C.NO2只是还原剂D.NO2既是氧化剂,又是还原剂
必须加入氧化剂后才能发生的变化是( )A.Cl2→Cl-B.Cl-→Cl2C.Cu2+→CuD.C
必须加入氧化剂后才能发生的变化是( )A.Cl2→Cl-B.Cl-→Cl2C.Cu2+→CuD.CO32-→CO2












