用脱脂棉包住约0.2g过氧化钠固体粉末 置于石棉网上 然后向包有过氧化钠的位置滴加几滴水 结果脱脂棉
用脱脂棉包住约0.2g过氧化钠固体粉末,置于石棉网上,然后向包有过氧化钠的位置滴加几滴水,结果脱脂棉剧烈燃烧起来。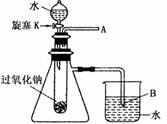 试完成下列问题: (1)写出过氧化钠与水反应的化学方程式 (2)结合脱脂棉剧烈燃烧的实验事实及燃烧的条件可以得出的结论是 (3)某研究性学习小组,为进一步证明上述结论,拟用如图所示的装置进行有关实验。请写出有关的实验操作方法 现象:A处: B处: |
参考解答
| (1) 2Na2O2 + 2H2O=4NaOH+O2↑ (2)过氧化钠与水反应放出热量并有助燃气体放出 (3)打开A,并在A处放一带火星的木条;带火星的木条复燃;有气泡放出 |
试题分析:(1)过氧化钠与水反应生成氢氧化钠和氧气,反应的化学方程式2Na2O2 + 2H2O=4NaOH+O2↑。 (2)根据物质燃烧的条件可知,脱脂棉剧烈燃烧,说明该反应是放热反应,且反应中有助燃性气体生成,即得出的结论是过氧化钠与水反应放出热量并有助燃气体放出。 (3)如果进一步证明上述结论,则需要打开K使水与过氧化钠反应生成氧气,同时在A处放一带火星的木条即可。 点评:该题是中等难度的试题,试题基础性强,侧重实验能力的培养和训练。该类试题要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论,有利于培养学生分析问题、解决问题的能力。 |
相似问题
Na2CO3·10H2O与NaHCO混合物4.54 g 溶于水配成100mL溶液 c(Na+)=0.
Na2CO3·10H2O与NaHCO混合物4 54 g,溶于水配成100mL溶液,c(Na+)=0 4mol L,另取等质量的混合物加强热至质量不变,求剩余固体的质量为多少?
除去Na2CO3固体中少量NaHCO3的最佳方法是A.加入适量盐酸B.加热C.加入NaOH溶液D.配
除去Na2CO3固体中少量NaHCO3的最佳方法是A.加入适量盐酸B.加热C.加入NaOH溶液D.配成溶液后通入CO2
已知A B C D为常见单质 其中B C D常温常压下为气体 甲 乙 丙 丁为化合物 乙常温下为液体
已知A、B、C、D为常见单质,其中B、C、D常温常压下为气体,甲、乙、丙、丁为化合物,乙常温下为液体,丙的焰色反应为黄色,下图为各种物质之间的相互反应
相同质量的钠在下列情况下产生氢气最多的是A.投入到足量水中B.投入到足量盐酸中C.投入到足量CuSO
相同质量的钠在下列情况下产生氢气最多的是A.投入到足量水中B.投入到足量盐酸中C.投入到足量CuSO4溶液中D.用刺有小孔的铝箔包好放入足量水中
已知某纯碱试样中含有NaCl杂质 为测定试样中纯碱的质量分数 可用下图中的装置进行实验。(提示:碱石
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。(提示:碱石灰是生石灰与氢氧化钠的混合物,可以吸收水和二氧












