欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。方法四:不使用化学试剂
欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。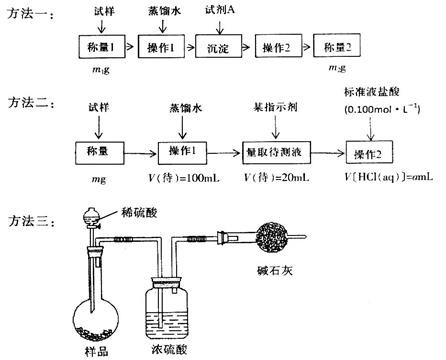 方法四:不使用化学试剂,使用实验室常用仪器。 按要求回答下列问题: (1)方法一是将HCO3-离子转化为沉淀并称重,则试剂A为______________(填化学式)溶液;操作2包括_______________________。 (2)方法二操作1中要用到的玻璃仪器有烧杯、玻璃棒,还需要___________________;操作2的名称是__________;该样品中NaHCO3的质量分数为_________(用含m、a的表达式表示)。 (3)根据方法三中所用的实验装置,除了称量试样质量外,还需测定的实验数据是_______________;仔细分析该实验装置,由此测得的数据计算出的实验结果有可能偏高也有可能偏低,偏高的原因可能是______________________________;偏低的原因可能是____________________________。 (4)方法四的实验原理是________________(用化学方程式表示)。 |
参考解答
| (9分)(1)Ba(OH)2[或Ca(OH)2;过滤、洗涤、干燥(有错不得分) (2)100ml容量瓶、胶头滴管;中和滴定; 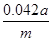 (或 (或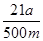 ) )(3)m(CO2)(或实验前后干燥管的质量);空气中的二氧化碳、水蒸气等进入干燥管;装置中的二氧化碳没有完全排入干燥管 (4)2NaHCO3  Na2CO3+H2O+CO2↑(每空1分) Na2CO3+H2O+CO2↑(每空1分) |
试题分析:(1)要将HCO3-离子转化为沉淀并称重,则需要加入强碱氢氧化钡或氢氧化钙,化学式分别为Ba(OH)2或Ca(OH)2;不溶性物质从溶液中分离出的操作是过滤,所得的沉淀还需要经过洗涤并干燥后才能称量。 (2)要配制100ml待测液,则操作1中要用到的玻璃仪器除了有烧杯、玻璃棒外,还需要100ml容量瓶,以及定容时的胶头滴管。标准盐酸滴定碳酸氢钠溶液,所以操作2的名称是中和滴定;20ml待测液消耗盐酸的物质的量是a×10-4mol,则根据方程式NaHCO3+HCl=NaCl+H2O+CO2↑可知,原样品中碳酸氢钠的物质的量是a×10-4mol× 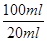 =5a×10-4mol,其质量=5a×10-4mol×84g/mol=0.042ag,所以该样品中NaHCO3的质量分数为 =5a×10-4mol,其质量=5a×10-4mol×84g/mol=0.042ag,所以该样品中NaHCO3的质量分数为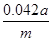 。 。(3)碳酸氢钠与盐酸反应生成CO2,则通过计算CO2的质量即可以算出碳酸氢钠的含量,所以根据方法三中所用的实验装置,除了称量试样质量外,还需测定的实验数据是m(CO2)或实验前后干燥管的质量;由于干燥管与大气相连,所以空气中的二氧化碳、水蒸气等进入干燥管,导致测量结果偏高;由于装置中的二氧化碳没有完全排入干燥管,还有残余,因此会导致测量结果偏低。 (4)由于碳酸氢钠不稳定,受热易分解生成碳酸钠、水和CO2,据此也可以测量碳酸氢钠的含量,所以方法四的实验原理是2NaHCO3  Na2CO3+H2O+CO2↑。 Na2CO3+H2O+CO2↑。 |
相似问题
(15分)Na2O2是常见的氧化剂 某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物。[
(15分)Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物。[实验步骤]I、按下图所示装置(部分仪器未画出)组装仪器,并
钠是活泼金属的代表 钠和钠的化合物是中学化学的基础知识。请回答下列有关问题。(1)钠跟水剧烈反应 生
钠是活泼金属的代表,钠和钠的化合物是中学化学的基础知识。请回答下列有关问题。(1)钠跟水剧烈反应,生成和氢气(H2),此实验说明钠的化学性质活泼;(2)
含有一定量NaOH溶液中 逐渐通入一定量 CO2 充分反应后 将溶液在一定条件下进行蒸干 得到晶体物
含有一定量NaOH溶液中,逐渐通入一定量 CO2,充分反应后,将溶液在一定条件下进行蒸干,得到晶体物质。其质量m 与通入气体体积V(CO2)的关系如图。如下
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种自色固体 用不同的方法做了以下实验 如图I~Ⅳ所示。(1
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种自色固体,用不同的方法做了以下实验,如图I~Ⅳ所示。(1)只根据图I、Ⅱ所示实验,能够达到实验目的的是
常温下 将Na2CO3和NaHCO3两种盐按物质的量比1:2混合后溶于水配成稀溶液 下列有关该混合溶
常温下,将Na2CO3和NaHCO3两种盐按物质的量比1:2混合后溶于水配成稀溶液,下列有关该混合溶液说法正确的是A.溶液中c(CO32-):c(HCO3-)<1:2B.溶液中c(












