(11分)A B C D是四种短周期元素 它们的原子序数依次增大。其中A D元素同主族 B C元素同
(11分)A、B、C、D是四种短周期元素,它们的原子序数依次增大。其中A、D元素同主族,B、C元素同周期;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表所示: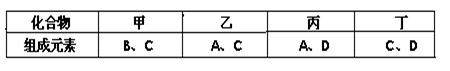 常温下,甲物质为气体,密度略小于空气;乙物质为液体;丙物质和丁物质为固体且都为离子化合物。请填写下列空白: (1)丙物质的电子式为 ,丁物质中阴离子与阳离子的个数之比为 。 (2)若标准状况下5.6L甲物质完全燃烧放出的热量为QKJ,试写出表示甲物质燃烧热的热化学方程式 。 (3)B、C两种元素按原子个数比为1:2可形成化合物戊,A、C、D三种元素按原子个数比为1:1:1可形成化合物己,则己与戊按物质的量之比为3:2完全反应后的溶液中各离子浓度的大小关系为 。 (4)某同学设计了一个以结构简式是BA3-CA物质为燃料的电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如下图: 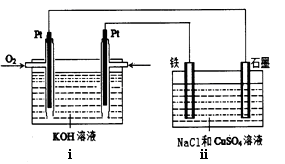 ①写出ⅰ中通入该物质这一极的电极反应式 。 ②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ;在t2时所得溶液的pH约为 。 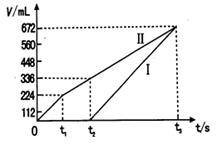 |
参考解答
| (1) Na+[:H- 1:2 (各1分) (2) CO(g)+1/2O2(g)= CO2 (g) ;△H=-4akJ/mol(2分) (3)c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) (2分) (4)① CH3OH - 6e-+ 8OH- = CO32-+ 6H2O (2分) ② 4OH- - 4e- = O2↑+ 2H2O (或2 H2O - 4e- = O2↑+4 H+-) (2分) 1 (合理答案均可) (1分); |
试题分析:(1)由题意可推断出,ABCD四种元素分别是H、C、O、Na,故丙物质为NaH,氢为-1价,电子式为 Na+[:H-;丁物质为Na2O2,阴离子为O22-,故阴阳离子个数比为1:2 ; (2)甲物质为CO,标准状况下5.6L即0.25molCO完全完全燃烧放出的热量为QKJ,故热化学方程式为CO(g)+1/2O2(g)= CO2 (g) ;△H=-4QkJ/mol; (3)戊物质为CO2,己物质为NaOH,己与戊按物质的量之比为3:2完全反应,主要产物为NaHCO3,碱过量,溶液显碱性,故反应后各离子浓度的大小关系为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) ; (4) 该燃料电池,i为电解池,ii为原电池,通入甲醇的电极反应式为CH3OH - 6e-+ 8OH- = CO32-+ 6H2O,在t1后,石墨电极上的电极反应式4OH- - 4e- = O2↑+ 2H2O (或2 H2O - 4e- = O2↑+4 H+-);在t2时所得溶液的pH约为1,可通过简单计算获得。 点评:本题涉及的范围较广,学生需要全面掌握各个知识点的联系,难度较大的是燃料电池部分,还涉及到有关计算,考查学生严谨、仔细的态度。 |
相似问题
下列变化既有化学键的破坏又有化学键的形成的是( )A.碘升华B.冰融化C.浓盐酸挥发D.NH4Cl
下列变化既有化学键的破坏又有化学键的形成的是()A.碘升华B.冰融化C.浓盐酸挥发D.NH4Cl受热分解
下列变化过程中 无化学键断裂或生成的是 A.石墨转化为金刚石B.NaCl晶体溶于水C.干冰升华D.
下列变化过程中,无化学键断裂或生成的是 A.石墨转化为金刚石B.NaCl晶体溶于水C.干冰升华D.HCl溶于水
下列关于化学键的说法正确的是A.化学键是分子与分子之间的作用力B.形成物质中的化学键时 要吸收能量C
下列关于化学键的说法正确的是A.化学键是分子与分子之间的作用力B.形成物质中的化学键时,要吸收能量C.化学键的断裂和形成吸收或放出的能量不同是化学
(8分)1918年 Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件 但
(8分)1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反
下列说法中正确的是( )A 化学键是原子间强烈的相互作用 B 化学键将原子或离子按一定的
下列说法中正确的是()A 化学键是原子间强烈的相互作用B 化学键将原子或离子按一定的数量关系结合在一起形成了物质C 一切物质中都存在化学键D 共价












