(8分)1918年 Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件 但
(8分)1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。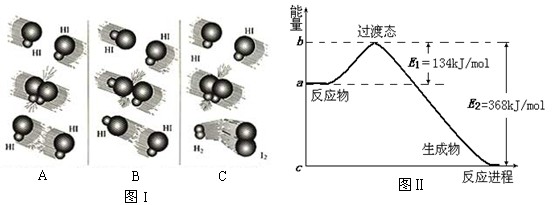 (1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是 (选填“A”、“B”或“C”); (2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ; (3)过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图; (4)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
已知:反应CH4(g)+Cl2(g)=CH3Cl(g)+HCl(g);△H=-106kJ/mol,则上表中X= 。 |
参考解答
| (8分)(1)C (2) NO2(g)+CO(g)=CO2(g)+NO(g);ΔH=-234 kJ/mol (3)(见图) (4)413 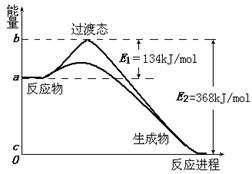 |
| (1)C中有产物氢气及碘蒸气的生成 (2)由图可知△H=-234kJ·mol-1 (3)加入催化剂,只是减小活化能,但起始状态并不改变,具体见图 (4) △H=4X+243-3X-330-432=-106kJ/mol,可推出X=413 |
相似问题
下列说法中正确的是( )A 化学键是原子间强烈的相互作用 B 化学键将原子或离子按一定的
下列说法中正确的是()A 化学键是原子间强烈的相互作用B 化学键将原子或离子按一定的数量关系结合在一起形成了物质C 一切物质中都存在化学键D 共价
反应。温度为时 平衡常数温度调至时 。下列说法不正确的是A.该反应为放热反应B.由到是降温过程C.时
反应。温度为时,平衡常数温度调至时,。下列说法不正确的是A.该反应为放热反应B.由到是降温过程C.时,增大不变D.时,的转化率比时小
下列电子式中 书写正确的是
下列电子式中,书写正确的是
下列说法中 错误的是( )A.键长越长 化学键越牢固B.成键原子间原子轨道重叠越多 共价键越牢固
下列说法中,错误的是()A.键长越长,化学键越牢固B.成键原子间原子轨道重叠越多,共价键越牢固C.对双原子分子来讲,键能越大,含有该键的分子越稳定
火山爆发产生的气体中含有1%的羰基硫(化学式为COS C===O就是羰基) 已知羰基硫分子中所有原子
火山爆发产生的气体中含有1%的羰基硫(化学式为COS,C===O就是羰基),已知羰基硫分子中所有原子最外层均满足8电子稳定结构,结合元素周期表知识,下列有关












