已知A元素原子核外电子共占有5个轨道且有2个成单电子;B元素原子核外能量最高电子为:n=3 l=1
已知A元素原子核外电子共占有5个轨道且有2个成单电子;B元素原子核外能量最高电子为:n=3、l=1、m=1、ms=+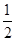 ,n=3、l=1、m=0、ms=+ ,n=3、l=1、m=0、ms=+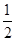 。则A、B两元素所形成化合物的晶体类型为( )。 。则A、B两元素所形成化合物的晶体类型为( )。A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体 |
参考解答
| B |
| A的核外电子排布式为1s22s22p4,A为O元素;B有3个电子层,且最高能量的电子有2个且为p电子,那么B为1s22s22p63s23p2,B为Si。SiO2为原子晶体。 |
相似问题
现有四种晶体 其离子排列方式如图所示 其中化学式不属AB型的是( )A.B.C.D.
现有四种晶体,其离子排列方式如图所示,其中化学式不属AB型的是( )A.B.C.D.
有A B C D四种元素 A元素和B元素的原子都有1个未成对电子 A+比B-少一个电子层 B原子得一
有A、B、C、D四种元素,A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未
下列各类物质中 固态时只能形成离子晶体的是( )。A.非金属氧化物B.非金属单质C.强酸D.强碱
下列各类物质中,固态时只能形成离子晶体的是()。A.非金属氧化物B.非金属单质C.强酸D.强碱
下列叙述中 不正确的是 [ ]A.微粒半径由小到大顺序是:H+
下列叙述中,不正确的是 [ ]A.微粒半径由小到大顺序是:H+<Li+<H- B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子 C.[Cu(NH3)4]2+离子
据美国《科学》杂志报道:在40GPa高压下 用激光器加热到1800 K 制得具有高熔点 高硬度的二氧
据美国《科学》杂志报道:在40GPa高压下,用激光器加热到1800 K,制得具有高熔点、高硬度的二氧化碳晶体。下列关于该晶体的说法正确的是( )A.该晶体属












