(14分)已知A B C D E F都是周期表中前四周期的元素 它们的原子序数依次增大。其中A C原
| (14分) 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。 请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示) (1)写出A、B、C三种元素电负性由大到小的顺序 。 (2)由A、B、C和氢四种元素组成的某种离子晶体,1mol该晶体含有配位键2mol,该晶体的化学式是 。 (3)F和Mn(锰)两元素的部分电离能数据列于下表:预测a b(填“大于”、“小于”、“等于”),理由是
(4)AC2分子中σ键和π键数目比为 ; (5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
② 熔点、沸点差异的主要原因 ②在水中的溶解度差异的主要原因 | ||||||||||||||||||||||||||
参考解答
| (14分)每空2分(1)O>N>C (2)(NH4)2CO3 (3)大于 ;锰离子的3d轨道电子排布为半满状态,较稳定。 (4) 1:1 (5)①过氧化氢分子之间存在氢键 ②过氧化氢分子与水分子之间可以形成氢键 |
试题分析:F3+离子M层3d轨道电子为半满状态,所以根据构造原理可知,F是Cr元素。A、C原子的L层有2个未成对电子,又因为A的原子序数最小,所以A是C,C是O,则B是N元素。D的二价阳离子与C的阴离子具有相同的电子层结构,因此D是Mg。D与E同主族,所以E是Ca。 (1)非金属性越强,电负性越大,则电负性大小顺序是O>N>C。 (2)1mol该晶体含有配位键2mol,说明含有1mol化合物中含有2molNH4+,所以该化合物是碳酸铵,化学式是(NH4)2CO3。 (3)由于锰离子的3d轨道电子排布为半满状态,较稳定,所以第三电离能是a大于b。 (4)CO2分子中含有碳氧双键,由于双键都是由1个α键和1个π键构成的,所以分子中σ键和π键数目比为1:1。 (5)①由于过氧化氢分子之间存在氢键,所以过氧化氢的沸点高, ②同样由于过氧化氢分子与水分子之间可以形成氢键,所以在水中的溶解度大。 点评:该题是高考中的常见题型,属于中等难度的试题。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。 |
相似问题
(1)氨气易溶于水生成氨水 氨水电离生成铵根离子 铵根离子中氮原子采取________杂化 NH4+
(1)氨气易溶于水生成氨水,氨水电离生成铵根离子,铵根离子中氮原子采取________杂化,NH4+中H—N—H键角比NH3中H—N—H键角大,原因是_________________
下列原子中有21个中子的是[ ]A.147N B.2110NeC.4019K D.4521S
下列原子中有21个中子的是[ ]A.147N B.2110NeC.4019K D.4521Se
下列各选项中两种粒子所含电子数不相等的是[ ]A.羟基(-OH)和氢氧根(OH-)B.甲烷(
下列各选项中两种粒子所含电子数不相等的是[ ]A.羟基(-OH)和氢氧根(OH-)B.甲烷(CH4)和铵根(NH4+) C.氨气(NH3)和水(H2O)D.双氧水(H2O2)氯化氢(HCl)
下列对分子或离子的立体构型判断不正确的是 ( )。A.NH4+和CH4都是正四面体形B.CO2和
下列对分子或离子的立体构型判断不正确的是 ( )。A.NH4+和CH4都是正四面体形B.CO2和CS2都是直线形C.NCl3和BCl3都是三角锥形D.H2O和H2S都是V形
气体分子中的极性键在红外线的照射下 易像弹簧一样做伸缩和弯曲运动 从而产生热量而造成温室效应。下列不
气体分子中的极性键在红外线的照射下,易像弹簧一样做伸缩和弯曲运动,从而产生热量而造成温室效应。下列不属于温室效应气体的是( )A.CO2B.N2O C.CH4D.N2


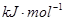 )
)









