(1)在一定体积的密闭容器中 进行如下化学反应 CO2(g)+H2(g)CO(g)+H2O(g)。其
(1)在一定体积的密闭容器中,进行如下化学反应,CO2(g)+H2(g) CO(g)+H2O(g)。其化学平衡常数K与温度t的关系如下。请回答下列问题: CO(g)+H2O(g)。其化学平衡常数K与温度t的关系如下。请回答下列问题:
①该反应的化学平衡常数的表达式K = ,由上表数据可得,该反应为 反应。(填“吸热”或“放热”) ②800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO)="0.01" mol·L-1、c(H2O)="0.03" mol·L-1、c(CO2)="0.01" mol·L-1、c(H2)="0.05" mol·L-1,则反应开始时,H2O的消耗速率比生成速率 (填"大"、"小"  或"不能确定") 或"不能确定")③830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为 。 (2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O CH3OH(g)+H2O (g) △H=-49.0kJ·mol-1。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示: (g) △H=-49.0kJ·mol-1。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示: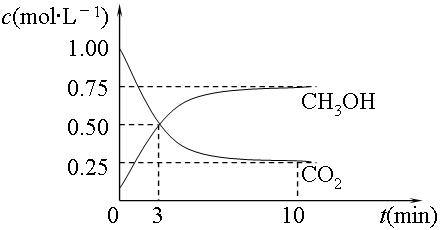 ①平衡时CH3OH的体积分数w为 。 ②现在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数  据如下。下列说法正确的是 据如下。下列说法正确的是
D.(a1+ a3)<1 E.2P1> P3 F.a1= a2 ③在一个装有可移动活塞的容器中进行上述反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。反应达到平衡后,测得CH3OH的物质的量为a mol,保持容器内的温度和压强不变,向平衡体系中通入少量的H2,再次达到平衡后,测得CH3OH的物质的量为b mol,请比较a、b的大小 。 CH3OH(g)+H2O(g)。反应达到平衡后,测得CH3OH的物质的量为a mol,保持容器内的温度和压强不变,向平衡体系中通入少量的H2,再次达到平衡后,测得CH3OH的物质的量为b mol,请比较a、b的大小 。 |
参考解答
| (1)①K=c(CO)×c(H2O)/c(CO2)×c(H2) (1分),吸热(1分); ②小(1分);③CO2的转化率为1/3(1分) (2)①30%(2分),②BDE(2分) ③a<b(1分)。[解答为说明问题方便起见,设原浓度皆为1mol?L-1,加入H2时,H2的浓度增大,设为原浓度的x倍(x>1),CO2、CH3OH、H2O的浓度均减小相同倍数,设为原来浓度的y倍(y<1),则Q(浓度商)= y/x3 K(K为平衡常数),所以Q<K,平衡向正反应方向移动,故得a<b。 |
| 略 |
相似问题
在一密闭烧瓶中注入NO2 在25℃时建立下列平衡:2NO2(g) N2O4(g) △H
在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2(g) N2O4(g),△H<0,若把烧瓶置于100℃的沸水中,下列物理量没有发生改变的是:①颜色;②平均相对分子质
(7分)在10℃和2×105Pa的条件下 反应aA(g) + bB(g) cC(g)建立平衡后再逐步
(7分)在10℃和2×105Pa的条件下,反应aA(g) + bB(g) cC(g)建立平衡后再逐步增大体系的压强(温度不变)。下表列出了不同压强下反应建立平衡时物质A的
(11分) T ℃时 将3mol气体A和1mol气体B通入体积为2L的密闭容器内(容积不变) 发生
(11分) T ℃时,将3mol气体A和1mol气体B通入体积为2L的密闭容器内(容积不变),发生反应:3A(g)+B(g)xC(g) ,2min时反应达到平衡状态(温度不变),
工业上利用反应:CO(g)+H2O(g) CO2(g)+H2(g);△H='Q' kJ·mol-
工业上利用反应:CO(g)+H2O(g) CO2(g)+H2(g);△H="Q" kJ·mol-1,制备H2 已知该反应的平衡常数K与温度的关系如图所示。若在一容积固定的密闭容器中,于
N2O5是一种新型硝化剂 在一定温度下可发生下列反应:2N2O5(g) 4NO2(g)+ O2(g)
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) 4NO2(g)+ O2(g);△H >0,T1温度下的部分实验数据如下表 下列说法不正确的是t s0500100015












