N2O5是一种新型硝化剂 在一定温度下可发生下列反应:2N2O5(g) 4NO2(g)+ O2(g)
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) 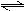 4NO2(g)+ O2(g);△H >0,T1温度下的部分实验数据如下表.下列说法不正确的是 4NO2(g)+ O2(g);△H >0,T1温度下的部分实验数据如下表.下列说法不正确的是
B.T1温度下的平衡常数为K1 =125,1000s时转化率为50% C.其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1 <T2 D.T1温度下的平衡常数为K1 ,T3温度下的平衡常数为K3,若K1> K3,则T1>T3 |
参考解答
| C |
2N2O5(g) 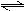 4NO2(g)+ O2(g) 4NO2(g)+ O2(g)起始浓度5.00 0 0 变化浓度1.48 2.96 0.74 500s浓度3.52 所以,500s内N2O5分解速率 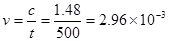 A正确 A正确T1温度下1000s时转化率若为50%则 根据方程式:2N2O5(g) 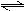 4NO2(g)+ O2(g), 4NO2(g)+ O2(g),起始浓度 5.00 0 0 变化浓度 2.50 5.00 1.25 平衡浓度 2.50 5.00 1.25 则 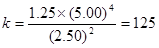 ,即B正确 ,即B正确其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,,比T1温度下浓度高,则说明在温度为T2时,平衡向逆反应方向移动,因正反应方向为吸热反应,所以降温平衡将向放热反应即逆反应移动,C错 同理也可分析知D正确; |
相似问题
在合成氨反应中 开始充入a mol N2和b mol H2 在一定条件下 反应达平衡 测得NH3占混
在合成氨反应中,开始充入a mol N2和b mol H2,在一定条件下,反应达平衡,测得NH3占混合气体的25%,则平衡时N2的转化率是()A.(0 1+10b a)%B.0 1
一定温度下 在一个容积为1L的密闭容器中 充入1mol H2(g)和1mol I2(g) 发生反应H
一定温度下,在一个容积为1L的密闭容器中,充入1mol H2(g)和1mol I2(g),发生反应H2(g)+ I2(g)2HI(g),经充分反应达到平衡后,生成的HI(g)的气体体积
(13分)工业合成氨是硝酸工业中的重要步骤 已知N2(g) +3H2(g) 2NH3(g) ΔH=
(13分)工业合成氨是硝酸工业中的重要步骤,已知N2(g) +3H2(g) 2NH3(g)ΔH=-92 4kJ·mol-1。请回答:(1) 当合成氨反应达到平衡后,改变某一外界条
对于0.1mol/L CH3COOH溶液 下列叙述正确的是A.加入水时 平衡逆反应方向移动B.加入少
对于0 1mol L CH3COOH溶液,下列叙述正确的是A.加入水时,平衡逆反应方向移动B.加入少量的NaOH固体,平衡向正反应方向移动C.加入少量0 1 mol L HCl
(8分)已知一定温度和压强下 在容积为VL的密闭容器中充入1mol A和1mol B 保持恒温恒压下
(8分)已知一定温度和压强下,在容积为VL的密闭容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g) + B(g) C(g)△H<0。达到平衡时,C的体积分数












