如下图 先向B中充入2molX 2molY 关闭活塞K 再向A充入1molX 1molY 使起始时A
如下图,先向B中充入2molX、2molY,关闭活塞K,再向A充入1molX、1molY,使起始时A、B的体积相等都等于a L,在相同温度和催化剂存在的条件下,两容器中各自发生下述反应,X(g)+ Y(g) 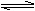 2 Z(g)+W(g); A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L 。下列说法错误的是 2 Z(g)+W(g); A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L 。下列说法错误的是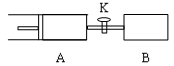 A.反应速率:v(B)  >v(A) >v(A) B.A容器中X的转化率为 80% C.A中混合气体密度不再变化能够证明 A中反应达到平衡状态 D.B中混合气体密度不再变化能够证明 B中反应达到平衡状态 |
参考解答
| D |
答案:B A、正确,B如果恒压达到平衡体积应为2.8aL,现只有aL,浓度大速率快; B、不正确,由方程式,每1molX参加反应,物质的量会增加1mol,现增加0.4aL,反应的X为0.4aL, A容器中X的转化率为0.4÷1=0.4,即40%。 C、正确,A平衡移动时,体积发生变化,但气体的总质量不变; D、正确,B平衡移动时,体积不发生变化,但气体的总质量不变。 |
相似问题
下列叙述正确的是A.恒容密闭容器中进行的反应3A(g) B(g)+C(g) 在其它条件不变情况下 再
下列叙述正确的是A.恒容密闭容器中进行的反应3A(g) B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将增大B.对于可逆反应N2(
如图所示 隔板K1固定不动 活塞K2可自由移动。T℃时 M N两个容器中均发生反应N2(g)+3H2
如图所示,隔板K1固定不动,活塞K2可自由移动。T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)2NH3(g),向容器M、N中各充入l mol N2和3 mol H2
向恒温 恒容(2L)的密闭容器中充入2 mol SO2和一定量的O2 发生反应:2SO2(g)+O2
向恒温、恒容(2L)的密闭容器中充入2 mol SO2和一定量的O2,发生反应:2SO2(g)+O2(g)2SO3(g);△H= -197 74 kJ·mol-1,4min后达到平衡,这
(8分)在一定体积的密闭容器中 进行如下化学反应:CO2(g)+H2(g)==CO(g)+H2O(g
(8分)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)==CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:t℃70080083010001200
下列事实 不能用平衡移动原理解释的是A.红棕色的NO2 加压后颜色先变深后变浅B.将FeS固体投入到
下列事实,不能用平衡移动原理解释的是A.红棕色的NO2,加压后颜色先变深后变浅B.将FeS固体投入到含有Cu2+的废水中以除去Cu2+C.选择合适的催化剂可使水












