下列叙述正确的是A.恒容密闭容器中进行的反应3A(g) B(g)+C(g) 在其它条件不变情况下 再
下列叙述正确的是
|
参考解答
| A |
| A正确,恒容密闭容器中,充入A,相当于增大A的浓度,平衡向正反应方向移动,又该反应为正反应方向体积减小的反应,A的转化率将增大;B错,增大氮气浓度,即单位体积内活化分子数增多,有效碰撞次数增多,反应速率加快;C错,AlCl3溶液蒸干灼烧所得固体为Al2O3,而NaAl02溶液蒸干后灼烧还得NaAl02固体;D错,该反应的熵为减少的过程。 |
相似问题
如图所示 隔板K1固定不动 活塞K2可自由移动。T℃时 M N两个容器中均发生反应N2(g)+3H2
如图所示,隔板K1固定不动,活塞K2可自由移动。T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)2NH3(g),向容器M、N中各充入l mol N2和3 mol H2
向恒温 恒容(2L)的密闭容器中充入2 mol SO2和一定量的O2 发生反应:2SO2(g)+O2
向恒温、恒容(2L)的密闭容器中充入2 mol SO2和一定量的O2,发生反应:2SO2(g)+O2(g)2SO3(g);△H= -197 74 kJ·mol-1,4min后达到平衡,这
(8分)在一定体积的密闭容器中 进行如下化学反应:CO2(g)+H2(g)==CO(g)+H2O(g
(8分)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)==CO(g)+H2O(g)。其化学平衡常数K和温度t的关系如下表:t℃70080083010001200
下列事实 不能用平衡移动原理解释的是A.红棕色的NO2 加压后颜色先变深后变浅B.将FeS固体投入到
下列事实,不能用平衡移动原理解释的是A.红棕色的NO2,加压后颜色先变深后变浅B.将FeS固体投入到含有Cu2+的废水中以除去Cu2+C.选择合适的催化剂可使水
(14分)如图的甲 乙两容器 甲体积可变压强不变 乙保持体积不变。向两容器中分别充入1 mol A
(14分)如图的甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充入1 mol A、3 mol B,此时两容器体积均为500 mL,温度为T℃。


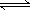 B(g)+C(g),在其它条件不变情况下,
B(g)+C(g),在其它条件不变情况下,









