如图所示 向A中充入1molX和1molY 向B中充入2molX和2molY 起始VA=VB=aL
如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应 X(g)+Y(g)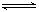 2Z(g)+W(g)达到平衡时,VA=1.2aL,则下列说法错误的是: 2Z(g)+W(g)达到平衡时,VA=1.2aL,则下列说法错误的是: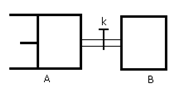
|
参考解答
| C |
| A、起始VA=VB=aL,B中的物质的量大于A中的物质的量,即B装置中的浓度大于A装置中的浓度,所以反应开始时,B反应速率大于A反应速率,故正确. B、等压、等温条件下,气体的体积之比大于气体的物质的量之比,达到平衡时,VA=1.2a L,所以平衡后混合气体的物质的量是2.4mol. 设A物质反应了mmol. X(g)+Y(g)?2Z(g)+W(g) 物质的量增多 1mol 1mol mmol (2.4-2)mol m=0.4 所以X物质的转化率= (0.4mol/1mol)×100%=40%; B装置是在等容条件下,反应向正反应方向移动时,混合气体的物质的量增大,导致容器内气体压强增大,增大压强能抑制X的转化率,故B正确 C、当打开K时,整个装置是在等温、等压条件下反应. 向将K打开,使整个装置中气体的压强与A装置中的初始压强相同时,A和B的体积之和为3aL,其中B占aL,则A占2aL;当等温等压条件下反应达到平衡状态时,混合气体的体积是用来的1.2倍,即混合气体的体积是3.6aL,其中B是aL,所以A是2.6aL,故C错误. D、该反应是一个反应前后气体体积增大的吸热反应,升高温度,平衡向正反应方向移动,混合气体的物质的量增大,导致A容器的体积增大,故D正确. 故选C. |
相似问题
如图所示 当关闭K时 向A中充入4molX 14molY 向B中充入2molX 7molY 起始时V
如图所示,当关闭K时,向A中充入4molX、14molY,向B中充入2molX、7molY,起始时V(A)=V(B)=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下
C+CO2 2CO(正反应吸热) 反应速率为v1:N2+3H2 2NH3(正反应放热) 反应速率为
C+CO2 2CO(正反应吸热),反应速率为v1:N2+3H22NH3(正反应放热),反应速率为v2。对于上述反应,当温度降低时,v1和v2的变化情况是()A.同时增大
下列事实能用勒夏特列原理解释的是A.合成氨工业采用高温条件B.配制FeSO4溶液时在溶液中加入稀硫酸
下列事实能用勒夏特列原理解释的是A.合成氨工业采用高温条件B.配制FeSO4溶液时在溶液中加入稀硫酸C.H2、I2、HI 平衡混合气体加压后颜色变深D.工业制
(8分)将等物质的量的A B混合于2 L的密闭容器中 发生如下反应:3A(g)+B(g) xC(g)
(8分)将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经5 min后达平衡状态,此时测得D的浓度为0 5 mol L,混合气
(10分).随着人类对温室效应和资源短缺等问题的重视 如何降低大气中CO2的含量及有效地开发利用CO
(10分).随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。⑴目前工业上有一种方法是












