利用化学原理可以对工厂排放的废水 废渣等进行有效检测与合理处理。 (一)染料工业排放的废水中含有大量
| 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。 (一)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO2-的离子方程式为_____________________。 (二)某工厂对制革工业污泥中Cr(III)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+) |
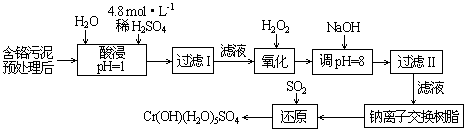 |
| 部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表 |
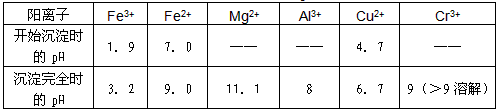 |
| (1)实验室用18.4mol·L-1的浓硫酸配制250mL 4.8mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需_______________________。 (2)酸浸时,为了提高浸取率可采取的措施是_____________(至少一条)。 (3)加入H2O2的作用是________________。 (4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的的杂质离子是______________(选填:Fe3+、Al3+、Ca2+、Mg2+)。 (三)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为 0.10 mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤 ①___________②__________ ③过滤。(提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu) |
参考解答
| (一)2Al+OH-+NO2-+2H2O=2AlO2-+NH3·H2O (二)(1)250mL容量瓶、胶头滴管;(2)反应温度、溶液的pH、搅拌速度、溶剂的配比等; (3)氧化Cr3+使之转变成+6价Cr6+,以便于与杂质离子分离;(4)Ca2+、Mg2+ (三)①通入足量氯气将Fe2+氧化成Fe3+ ;②加入CuO调节溶液的pH至3.2~4.7 |
相似问题
某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。(1)提出假设:该反应的气体产物全部是
某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。(1)提出假设:该反应的气体产物全部是二氧化碳。(2)设计方案:如图所示,将一定量
测定平衡常数对定量认识化学反应具有重要意义。已知:I2能与I-反应成I3- 并在溶液中建立如下平衡:
测定平衡常数对定量认识化学反应具有重要意义。已知:I2能与I-反应成I3-,并在溶液中建立如下平衡:I2 +I-I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),
工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应 某学习小组进行了以下探究活动[探究一]
工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动[探究一] (1)将已去除表面氧化物的铁钉(碳素钢)放入
为证明有关物质的性质 某学生设计了下图所示装置 当打开活塞C 使液体A与隔板H上的固体B相遇时 即有
为证明有关物质的性质,某学生设计了下图所示装置,当打开活塞C,使液体A与隔板H上的固体B相遇时,即有气体产生,并发现D中蜡烛(含碳、氢的化合物)慢慢
下列有关Na2CO3和NaHCO3性质的比较中 正确的是( )A.等浓度的溶液中滴入稀盐酸 放出气
下列有关Na2CO3和NaHCO3性质的比较中,正确的是()A.等浓度的溶液中滴入稀盐酸,放出气体的快慢Na2CO3<NaHCO3B.热稳定性Na2CO3<NaHCO3C.常温时水溶性












