某研究性学生小组查阅资料得知 漂白粉与硫酸溶液反应可制取氯气 化学方程式为:Ca(ClO)2+CaC
某研究性学生小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4
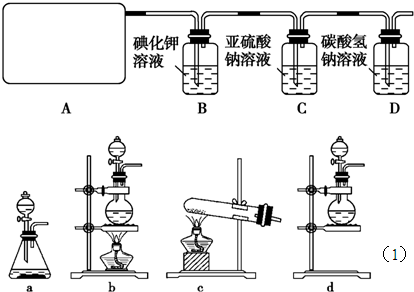 试回答: (1)该实验中A部分的装置是 (填写装置的序号); (2)B中反应的化学方程式是 ; (3)写出C中反应的离子方程式 ,并请你帮该小组同学设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤): ; (4)写出在D装置中发生反应的离子方程式 ; (5)该实验存在明显的缺陷是 ; (6)该小组又进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,加入过量的KI溶液和过量的H2SO4溶液,静置.待完全反应后,用0.1mol?L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为2Na2S2O3+I2═Na2S4O6+2NaI,反应完成时,共消耗Na2S2O3 200mL.则该漂白粉中Ca(ClO)2的质量分数为 . |
参考解答
答案:(1)b;
(2)Cl2+2KI=2KCl+I2;
(3)Cl2+SO32-+H2O=SO42-+2Cl-+2H+;取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化;
(4)Cl2+H2O=H++Cl-+HClO,HCO3-+H+=H2O+CO2↑(或者Cl2+HCO3-=CO2↑+Cl-+HClO );
(5)无尾气处理装置;
(6)35.8%(或35.75%)
解析:(1)该反应的反应物是固体和液体,反应条件是加热,所以应选固液混合加热型装置.
故选b.
(2)氯气有氧化性,能和碘化钾反应生成碘单质和氯化钾Cl2+2KI=2KCl+I2.
故答案为:Cl2+2KI=2KCl+I2;
(3)氯气有强氧化性,亚硫酸根离子有还原性,所以氯气和亚硫酸根离子能发生氧化还原反应生成硫酸根离子、氯离子和氢离子Cl2+SO32-+H2O=SO42-+2Cl-+2H+;如果亚硫酸钠被氧化,会生成硫酸钠,硫酸钠和氯化钡能发生 反应生成白色沉淀硫酸钡,亚硫酸钡也是沉淀,所以要先排除亚硫酸盐的干扰,再用氯化钡检验硫酸根离子,检验方法为取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化.
故答案为:Cl2+SO32-+H2O=SO42-+2Cl-+2H+;取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化
(4)氯气和水反应生成盐酸和次氯酸Cl2+H2O=H++Cl-+HClO,盐酸是强酸,能和碳酸氢根离子反应生成二氧化碳和水HCO3-+H+=H2O+CO2↑.
故答案为:Cl2+H2O=H++Cl-+HClO,HCO3-+H+=H2O+CO2↑(或者Cl2+HCO3-=CO2↑+Cl-+HClO );
(5)氯化氢有刺激性气味,尾气不能直接排空,要用尾气处理装置进行处理,所以该装置没有尾气处理装置.
故答案为:无尾气处理装置.
(6)设次氯酸钙的质量为x.
Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O①
2CaSO4+2Cl2↑+2H2O①
Cl2+2KI=2KCl+I2②
2Na2S2O3+I2═Na2S4O6+2NaI③
将方程式①+2×②+2×③得方程式
Ca(ClO)2+CaCl2+2H2SO4+4KI+4Na2S2O3=2CaSO4+4KCl+2H2O+2Na2S4O6+4NaI
143g 4mol
x 0.2L×0.1mol?L-1
所以x=0.715g
次氯酸钙的质量分数为0.715g/2.0g×100%=35.75% 故答案为35.75%.
相似问题
下列有关反应颜色变化的叙述中 正确的是( )①新制氯水久置后→浅黄绿色消失 ②淀粉溶液遇单质碘→蓝
下列有关反应颜色变化的叙述中,正确的是( )①新制氯水久置后→浅黄绿色消失 ②淀粉溶液遇单质碘→蓝色 ③蔗糖中加入浓硫酸搅拌→白色④SO2通入品
下列叙述中 不正确的是( )A.氯气能溶解于水B.氯气是一种有毒气体C.氯气 液氯和氯水是同一种物
下列叙述中,不正确的是( )A.氯气能溶解于水B.氯气是一种有毒气体C.氯气、液氯和氯水是同一种物质D.氯气是一种黄绿色、有刺激性气味的气体E.氯
将4.68gNaNO3 NaCl Na2CO3的混合物溶于水 向其中滴加30mL1.00mol/LA
将4 68gNaNO3、NaCl、Na2CO3的混合物溶于水,向其中滴加30mL1 00mol LAgNO3溶液后,不再有沉淀生成。过滤后,使沉淀与足量稀硝酸作用,产生112mL(标准状
将新制的氯水滴入下列溶液中 不发生反应的是( )A.碘化钠B.硫酸铁C.硝酸银D.氢氧化钠
将新制的氯水滴入下列溶液中,不发生反应的是( )A.碘化钠B.硫酸铁C.硝酸银D.氢氧化钠
常温下 向100mL0.05mol/L氢硫酸中逐渐通入氯气.下列叙述正确的是( )A.溶液pH先变
常温下,向100mL0 05mol L氢硫酸中逐渐通入氯气.下列叙述正确的是( )A.溶液pH先变大后变小B.溶液导电能力逐渐增强C.氢硫酸完全反应生成1 6g硫D












