为了探究HClO的漂白性 某同学设计了如下的实验.(1)通入Cl2后 从集气瓶A中干燥的红色布条的现
为了探究HClO的漂白性,某同学设计了如下的实验.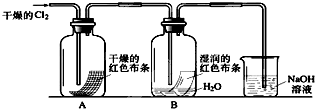 (1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是______;从集气瓶B中湿润的红色布条的现象可得出的结论是______,其中发生的反应的化学方程式为______. (2)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是______. (3)烧杯中溶液所起的作用是______,烧杯中所发生反应的化学方程式为______. (4)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时4分钟,小烧杯中盛2mol?L-1的NaOH溶液的体积至少应为______mL. |
参考解答
| (1)氯气不能使干燥的有色布条褪色,干燥的氯气没有漂白性,氯气能使湿润的有色布条褪色,因为氯气和水反应生成的次氯酸具有漂白性,原理方程式为:Cl2+H2O=HCl+HClO, 故答案为:干燥的氯气没有漂白性;氯水具有漂白性;Cl2+H2O=HCl+HClO; (2)氯气和水反应的产物是盐酸和次氯酸,要证明谁有漂白性,得做两个实验:证明盐酸是否有漂白性和证明次氯酸是否有漂白性的实验,故答案为:证明盐酸是否有漂白性; (3)氯气有毒,会造成空气污染,可以用氢氧化钠来吸收,反应生成氯化钠、次氯酸钠和水, 故答案为:吸收多余的氯气;Cl2+2NaOH=NaCl+NaClO+H2O (4)4分钟时n(Cl2)=
需要n(NaOH)=0.4mol, 所以V(NaOH)=
故答案为:200. |
相似问题
除去氯气中含有的少量水蒸气 所用试剂正确的是A.固体氢氧化钠B.生石灰C.浓盐酸D.浓硫酸
除去氯气中含有的少量水蒸气,所用试剂正确的是A.固体氢氧化钠B.生石灰C.浓盐酸D.浓硫酸
某溶液中含有NH4+ SO32- SiO32- Br- CO32- Na+ 向该溶液中通入过量的Cl
某溶液中含有NH4+、SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,则下列判断正确的是( )①反应前后,溶液中离子浓度基本保持不变的有
下列不能使有色布条褪色的物质是( )A.次氯酸钠溶液B.氯水C.漂白粉溶液D.氯化钙溶液
下列不能使有色布条褪色的物质是( )A.次氯酸钠溶液B.氯水C.漂白粉溶液D.氯化钙溶液
如下图所示的物质的相互转变中 反应①在工业上可用来生产化合物C 反应⑤在工业上可生产化合物J(Na2
如下图所示的物质的相互转变中,反应①在工业上可用来生产化合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反
丰富多彩的颜色变化增添了化学实验的魅力 下列有关反应颜色变化的叙述中 正确的是( )①新制氯水久置
丰富多彩的颜色变化增添了化学实验的魅力,下列有关反应颜色变化的叙述中,正确的是( )①新制氯水久置后→浅黄绿色消失 ②淀粉溶液遇碘化钾→蓝色












