已知Cl-和Ag+反应生成AgCl 每次新生成的AgCl中又有10%见光分解成单质银和氯气 氯气又可
| 已知Cl-和Ag+反应生成AgCl,每次新生成的AgCl中又有10%见光分解成单质银和氯气,氯气又可在水溶液中岐化成HClO3(为强酸)和HCl。而这样生成的Cl-又与剩余的Ag+作用生成沉淀,如此循环往复,直至最终。现有含1.1molNaCl的溶液,向其中加入足量AgNO3,求最终能生成多少克难溶物(AgCl和Ag)?若最后溶液体积为1L,求溶液中H+物质的量浓度是多少? |
参考解答
| 167.94g 0.12mol/L |
本题涉及三个化反应:Ag++Cl-=AgCl↓,2AgCl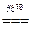 2Ag+Cl2;3Cl2+3H2O=6H++ClO3-+5Cl-, 2Ag+Cl2;3Cl2+3H2O=6H++ClO3-+5Cl-,若有①60Ag++60Cl-=60AgCl,则应有②6AgCl 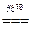 6Ag+3Cl2,③3Cl2+3H2O=ClO3-+5Cl-+6H+,消去循环量,可运用总反应式求解,①+②+③得:60Ag++55Cl-+3H2O=54AgCl↓+6Ag↓+ClO3-+6H+。 6Ag+3Cl2,③3Cl2+3H2O=ClO3-+5Cl-+6H+,消去循环量,可运用总反应式求解,①+②+③得:60Ag++55Cl-+3H2O=54AgCl↓+6Ag↓+ClO3-+6H+。据此易得: 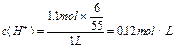 ; ;难溶物AgCl和Ag的质量为: 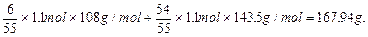 |
相似问题
为了探究HClO的漂白性 某同学设计了如下的实验.(1)通入Cl2后 从集气瓶A中干燥的红色布条的现
为了探究HClO的漂白性,某同学设计了如下的实验.(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是______;从集气瓶B中湿润的红色布条的
除去氯气中含有的少量水蒸气 所用试剂正确的是A.固体氢氧化钠B.生石灰C.浓盐酸D.浓硫酸
除去氯气中含有的少量水蒸气,所用试剂正确的是A.固体氢氧化钠B.生石灰C.浓盐酸D.浓硫酸
某溶液中含有NH4+ SO32- SiO32- Br- CO32- Na+ 向该溶液中通入过量的Cl
某溶液中含有NH4+、SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,则下列判断正确的是( )①反应前后,溶液中离子浓度基本保持不变的有
下列不能使有色布条褪色的物质是( )A.次氯酸钠溶液B.氯水C.漂白粉溶液D.氯化钙溶液
下列不能使有色布条褪色的物质是( )A.次氯酸钠溶液B.氯水C.漂白粉溶液D.氯化钙溶液
如下图所示的物质的相互转变中 反应①在工业上可用来生产化合物C 反应⑤在工业上可生产化合物J(Na2
如下图所示的物质的相互转变中,反应①在工业上可用来生产化合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反












