对于下列氧化还原反应 请按要求填空。 (1)Cu + 4HNO3(浓) === Cu(NO3)
| 对于下列氧化还原反应,请按要求填空。 (1)Cu + 4HNO3(浓) === Cu(NO3)2 + 2NO2↑ + 2H2O ①氧化剂____________②离子方程式____________________________ (2)2H2S + SO2 === 3S↓ + 2H2O ①用双线桥法标出电子转移的方向和数目____________________________ ②若氧化产物比还原产物多1.6g,则反应中电子转移的个数为________________ |
参考解答
| (1)①HNO3 ②Cu+4H++2NO3-=Cu2++2NO2↑+2H2O (2) 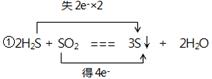 ②1.204×1023或0.2NA ②1.204×1023或0.2NA |
试题分析:(1)根据反应的化学方程式可知,铜元素的化合价从0价升高到+2价,失去2个电子,硝酸中氮元素的化合价从+5价降低到+4价,得到1个电子,所以氧化剂是硝酸,该反应的离子方程式是Cu+4H++2NO3-=Cu2++2NO2↑+2H2O。 (2)①该反应的化学方程式可知,H2S中S元素的化合价从-2价升高到0价,失去2个电子,做还原剂。SO2中S元素的化合价从+4价降低到0价,得到4个电子,做氧化剂,所以表示为 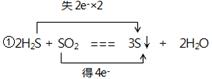 。 。②根据2H2S + SO2 === 3S↓ + 2H2O可知,每转移4个电子,氧化产物比还原产物多32g,所以若氧化产物比还原产物多1.6g,则反应中电子转移的物质的量为 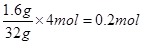 ,因此电子的个数是0.2NA。 ,因此电子的个数是0.2NA。点评:该题是中等难度的试题,试题注重基础,侧重能力的培养。该题的关键是准确标出有关元素的化合价变化情况,然后依据电子的得失守恒直接列式计算即可,有利于培养学生的逻辑思维能力和应试能力,以及规范的答题能力。 |
相似问题
A B两种元素的原子 当它们分别获得1个电子形成稀有气体原子的电子层结构时 A放出的能量大于B.下列
A、B两种元素的原子,当它们分别获得1个电子形成稀有气体原子的电子层结构时,A放出的能量大于B.下列叙述中正确的是( )A.A的还原性小于BB.B-的氧
下列五个反应中氧化剂氧化能力由强到弱的顺序为( )①2Fe+3Cl2FeCl②Fe+2HClFeCl
下列五个反应中氧化剂氧化能力由强到弱的顺序为()①2Fe+3Cl2FeCl②Fe+2HClFeCl+H↑③2KMnO+16HCl(浓)2KCl+2MnCl+5Cl↑+8HO④MnO+4HCl(浓)MnCl+Cl↑
根据以下几个反应:①Cl2+2KI2KCl+I2 ②2FeCl2+Cl22FeCl3③2FeCl3
根据以下几个反应:①Cl2+2KI2KCl+I2②2FeCl2+Cl22FeCl3③2FeCl3+2KI2KCl+I2 +2FeCl2④I2+SO2+2H2O2H2SO4+2HI判断氧化性由强到弱的顺序是( )A.Cl2>I2>
根据(1)Fe+Cu2+=Fe2++Cu (2)2Fe3++Cu=Cu2++2Fe2+
根据(1)Fe+Cu2+=Fe2++Cu (2)2Fe3++Cu=Cu2++2Fe2+(3)2Fe2++Cl2=2Fe3++2Cl- (4)HClO+H++Cl-=H2O+Cl2,可以判断出各粒子的氧化性由强
有下列氧化还原反应:①Fe+CuSO4==Cu+FeSO4 ②Cu+2FeCl3==CuCl2
有下列氧化还原反应:①Fe+CuSO4==Cu+FeSO4②Cu+2FeCl3==CuCl2+2FeCl2 ③2FeCl2+Cl2==2FeCl3根据上述反应可判断各粒子氧化性由强到弱的顺序正确的












