(1)写出一个能证明还原性Fe比Cu强的离子方程式:______;(2)根据上述反应设计一个原电池
| (1)写出一个能证明还原性Fe比Cu强的离子方程式:______; (2)根据上述反应设计一个原电池,画出简易装置图(标出电极名称、电极材料、电解质溶液 )______; (3)若该电池中两电极的总质量为60g,工作一段时间后,取出两电极洗净干燥后称量,总质量为62g,则反应过程中转移电子的数目为______. |
参考解答
| (1)铁比铜的还原性强,可与Cu2+发生置换反应,反应的离子方程式为Fe+Cu2+=Fe2++Cu,故答案为:Fe+Cu2+=Fe2++Cu; (2)在Fe+Cu2+=Fe2++Cu反应中,Fe被氧化,应为原电池的负极,Cu2+得电子被还原生成单质Cu,正极材料为活泼性比Fe的金属如Cu或非金属材料,电解质溶液为含Cu2+离子的溶液,如CuCl2,故答案为: 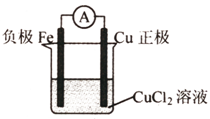 (3)设用xmolFe反应,根据电池总反应式计算, Fe+Cu2+=Fe2++Cu△m 1mol 8g xmol 62g-60g=2g x=0.25, 根据电极反应式可知Fe-2e-=Fe2+,转移的电子的物质的量为0.5mol, 反应过程中转移电子的数目为3.01×1023或0.5NA,故答案为:3.01×1023或0.5NA. |
相似问题
已知常温下 在溶液中可发生如下反应:Ce4+ + Fe2+ = Fe3+ + Ce3+ Sn2+
已知常温下,在溶液中可发生如下反应:Ce4+ + Fe2+ = Fe3+ + Ce3+, Sn2+ + 2Fe3+ = 2Fe2+ + Sn4+。由此推断Fe2+、Ce3+、Sn2+的还原性由强
比较 分析 归纳是学习化学的有效方法。现有反应:①Zn+CuCl2====ZnCl2+Cu;②Cu+
比较、分析、归纳是学习化学的有效方法。现有反应:①Zn+CuCl2====ZnCl2+Cu;②Cu+2AgNO3====Cu(NO3)2+2Ag; ③Cl2+2NaBr====2NaCl+Br2;④Br2+2NaI=
Co2O3 Cl2 FeCl3 I2的氧化性依次减弱.已知Co2O3在酸性溶液中易被还原成Co2+
Co2O3、Cl2、FeCl3、I2的氧化性依次减弱.已知Co2O3在酸性溶液中易被还原成Co2+,下列反应在水溶液中不可能发生的是( )A.3Cl2+6FeI2→2FeCl3+4FeI3
在常温下 发生下列几种反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O②2A2++
在常温下,发生下列几种反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O②2A2++B2=2A3++2B-③2B-+Z2=B2+2Z-根据上述反应,判断下列结论中错误的是( )A.溶液
(1)某学生在实验室做了5个实验 ①在铝盐溶液中逐滴加入稀氨水直至过量 ②在明矾溶液中加入NaOH
(1)某学生在实验室做了5个实验 ①在铝盐溶液中逐滴加入稀氨水直至过量, ②在明矾溶液中加入NaOH溶液直至过量, ③在强碱性溶液中逐滴加入铝盐溶液












