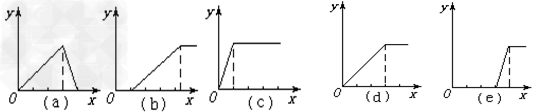
(1)某学生在实验室做了5个实验 ①在铝盐溶液中逐滴加入稀氨水直至过量 ②在明矾溶液中加入NaOH
| (1)某学生在实验室做了5个实验 ①在铝盐溶液中逐滴加入稀氨水直至过量, ②在明矾溶液中加入NaOH溶液直至过量, ③在强碱性溶液中逐滴加入铝盐溶液直至过量, ④在偏铝酸钠溶液中通入CO2直至过量, ⑤在强酸溶液中逐滴加入偏铝酸钠溶液直至过量。 并根据以上实验画出下列5种图象(纵坐标为沉淀物质的量,横坐标为溶液中加入物质的量)实验与图象对立关系正确的是:___________。 |
 |
| (2)已知:氧化性:KMnO4>HNO3;Bi位于周期表中VA,+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进行下列实验,现象记录如下。 ①滴加适量的NaBiO3溶液,溶液变为紫红色。 ②继续滴加适量H2O2,紫红色褪去,并有气泡产生。 ③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。 ④最后通入足量的SO2气体,请回答下列问题: (a)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为__________________________; (b)实验④中的现象为:_____________________________; (c)实验②反应的离子方程式是:_____________________。 (3)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题: |
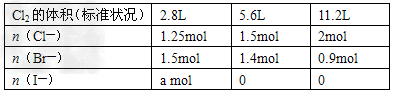 |
| ①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方_________________。 ②原溶液中Cl-、Br-、I-的物质的量浓度之比为:________________ 。 |
参考解答
| (1 )CD (2 )(a )PbO2>KMnO4>H2O2;(b )紫红色褪去,生成白色沉淀;(c )2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2 (3 )①Cl2+2I-==I2+2Cl- ;②10:15:4 |
相似问题
在常温下发生下列反应:(1)16H++10Z- +2XO4-=2X2++5Z2+8H2O(2)2A2
在常温下发生下列反应:(1)16H++10Z- +2XO4-=2X2++5Z2+8H2O(2)2A2++B2=2A3++2B-(3)2B-+Z2=B2+2Z- 根据上述反应,判断下列结论中错误的是[ ]A 溶液中可
某反应中反应物与生成物有:AsH3 H2SO4 KBrO3 K2SO4 H3AsO4 H2O和一种未
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(1)已知KBrO3在反应中得到电子,则该反应的还原剂是______________
美日科学家因在研究“钯催化交叉偶联反应”所作出的杰出贡献 获得了2010年诺贝尔化学奖。钯的化合物P
美日科学家因在研究“钯催化交叉偶联反应”所作出的杰出贡献,获得了2010年诺贝尔化学奖。钯的化合物PdCl2通过化学反应可用来检测有毒气体CO,该反应的反
判断下列物质的氧化能力由强到弱的顺序是 [ ]A.FeCl3>C12>I2B.C12>I2>
判断下列物质的氧化能力由强到弱的顺序是 [ ]A.FeCl3>C12>I2B.C12>I2>FeCl3 C.I2>Cl2>FeCl3 D.C12>FeCl3>l2
已知Co2O3在酸性溶液中易被还原成Co2+ 且Co2O3 Cl2 FeCl3 I2的氧化性依次减弱
已知Co2O3在酸性溶液中易被还原成Co2+,且Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列叙述中,正确的是[ ]A.Cl2通入FeI2溶液中,可存在反应3Cl2+6FeI












