(14分)湿法炼锌的冶炼过程可用下图简略表示:请回答下列问题: (1)已知:N2(g)+2H2(g)
(14分)湿法炼锌的冶炼过程可用下图简略表示: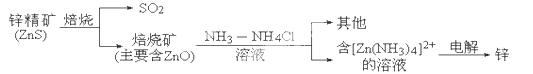 请回答下列问题: (1)已知:N2(g)+2H2(g)===N2H4(l) ΔH=a kJ·mol-1,该反应不能自发进行,则a 0(填“>”、“<”或“=”). (2)ZnS焙烧的反应2ZnS+3O2  2SO2+2ZnO所涉及的物质中,发生氧化反应的物质是 ,不含离子键的化合物是 . 2SO2+2ZnO所涉及的物质中,发生氧化反应的物质是 ,不含离子键的化合物是 .(3)电解过程中析出锌的电极反应式为___________________________. (4)产生的SO2可用Ba(NO3)2溶液吸收,部分产物可作为工业原料,其反应的离子方程式为 . (5)锌-空气电池与锂电池相比,具有储存电量高、成本低、没有安全隐患等优点。该电池的总反应为2Zn+O2===2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为 。25℃时,以该电池为电源,用两个等质量的铜棒作电极电解500 mL 0.1mol/L CuSO4溶液,一段时间后切断电源,对电极干燥并称量,测得两电极的质量差为9.6 g,则至少需要________L空气(折算成标准状况)进入该电池。 |
参考解答
| (1)>;(2)ZnS,SO2;(3)Zn[(NH3)42++2e-=Zn+4NH3↑; (4)3SO2+3Ba2++2H2O+2NO3-=3BaSO4↓+2NO↑+4H+;(5)Zn-2e-+2OH-=ZnO+H2O, 4.2L。 |
试题分析:(1)根据化学反应方向的判据ΔH—TΔS分析,吸热的熵减少的反应在任何条件下都不能自发进行,该反应是一个熵减小的反应,所以当该反应为吸热反应即a>0时,该反应在任何条件下都不能自发进行;(2)在氧化还原反应中,ZnS中硫元素的化合价由—2价升高到0价,发生氧化反应;活泼金属和非金属元素之间形成的化学键是离子键,如ZnS、ZnO,SO2属于共价化合物,只含有共价键;(3)电解池中,阳离子Zn[(NH3)42+在阴极上发生得电子的还原反应,电解反应式为:Zn[(NH3)42++2e-=Zn+4NH3↑;(4)二氧化硫酸性气体可以和硝酸钡溶液之间发生氧化还原反应,得到白色沉淀硫酸钡和NO气体,离子方程式为3SO2+3Ba2++2H2O+2NO3-=3BaSO4↓+2NO↑+4H+;(5)在锌-空气电池原电池的负极上是金属锌发生失电子的氧化反应,在碱性环境下,电极反应式为:Zn-2e-+2OH-=ZnO+H2O,以该电池为电源,用两个等质量的铜棒作电极电解500mL 0.1mol/L CuSO4溶液,阳极上是Cu-2e-=Cu2+,阴极上是Cu2++2e-=Cu,对电极干燥并称量,测得两电极的质量差为9.6g,则减少的铜和生成的铜各是4.8g即0.075mol,转移电子是0.15mol,根据反应2Zn+O2═2ZnO,当转移电子是4mol时,消耗氧气是1moL,所以转移电子是0.15mol时,消耗氧气是0.0375moL,氧气体积是空气提及的五分之一,所以消耗空气的体积是0.0375moL×5×22.4L/mol=4.2L。 |
相似问题
以黄铁矿(FeS2) 氯酸钠和硫酸溶液混合反应制备二氧化氯气体 再用水吸收获得二氧化氯溶液。在此过程
以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度, 若温度不当,副反应增加,
下列生活中的化学现象与氧化还原知识有关的是 [ ]A.菜刀洗过后如果没擦干放置一段时间就会
下列生活中的化学现象与氧化还原知识有关的是 [ ]A.菜刀洗过后如果没擦干放置一段时间就会出现斑点 B.用食醋可以洗水垢 C.蔗糖放在水中片刻后消失
已知2MOyx-+5S2-+16H+=2M2+ +5S↓+ 8H2O 则下列选项正确的是A.x=2B
已知2MOyx-+5S2-+16H+=2M2+ +5S↓+ 8H2O,则下列选项正确的是A.x=2B.氧化产物和还原产物的比为2:5C.生成4mol H2O转移10mol电子D.MOyx-中的M的化合价为+7
钨是我国丰产元素。自然界中钨主要以钨(+6)酸盐的形式存在。黑钨矿的主要成分是铁和锰的钨酸盐(FeW
钨是我国丰产元素。自然界中钨主要以钨(+6)酸盐的形式存在。黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4)。黑钨矿传统冶炼工艺流程图如下:(1)已知
向0.1 mol·L-1 NaOH溶液中通入过量CO2后 溶液中存在的主要离子是( )。A.Na+
向0 1 mol·L-1 NaOH溶液中通入过量CO2后,溶液中存在的主要离子是( )。A.Na+、CO32-B.Na+、HCO3-C.HCO3-、CO32-D.Na+、OH-












