以黄铁矿(FeS2) 氯酸钠和硫酸溶液混合反应制备二氧化氯气体 再用水吸收获得二氧化氯溶液。在此过程
以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度, 若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如图所示。请回答下列问题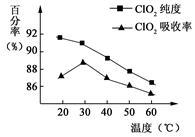 (1)据图可知,反应时需要控制的适宜温度是 ℃,达到此要求采取的适宜措施是 。 (2)已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式: 。 (3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得400 mL ClO2溶液,取出20 mL,加入37.00 mL 0.500mol· 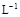 (NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol· (NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·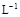 K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下: K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:4H++ClO2+5Fe2+= 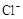 +5Fe3+ +2H2O 14H+ + +5Fe3+ +2H2O 14H+ +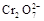 +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O试计算ClO2的“产率”。(写出计算过程) |
参考解答
| (1)30℃,水浴加热(或水浴控制恒温);(2)15ClO3-+FeS2+14H+=15ClO2+Fe3++7H2O+2SO42- (3)与K2Cr2O7反应的n(Fe2+)=6n(Cr2O72-)=6×20×10-3L×0.0500mol/L=6×10-3mol; 与ClO2反应的n(Fe2+)=37×10-3L×0.0500mol/L-6×10-3mol=1.25×10-2mol n(ClO2)= 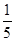 ×1.25×10-2mol=2.5×10-3mol ×1.25×10-2mol=2.5×10-3molClO2的产率= 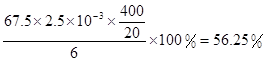 |
试题分析:(1)据图可知,在20℃反应时ClO2气体制取纯度高,但是气体的吸收率较低,在30℃无论是反应制取ClO2气体纯度高还是气体的吸收率都较高。若温度再升高,制取ClO2气体纯度高还是气体的吸收率都降低。所以需要控制的适宜温度是30℃。达到此要求采取的适宜措施是水浴加热(或水浴控制恒温)。(3)由方程式4H++ClO2+5Fe2+= 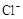 +5Fe3+ +2H2O 14H+ + +5Fe3+ +2H2O 14H+ +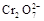 +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O可结合电子得失守恒可得1×n(Fe2+)=5×n(ClO2)+2×3×n(Cr2O72-).与K2Cr2O7反应的n(Fe2+)=6n(Cr2O72-)=6×20×10-3L×0.0500mol/L=6×10-3mol;与ClO2反应的n(Fe2+)=37×10-3L× 0.0500mol/L -6×10-3mol=1.25×10-2mol。所以n(ClO2)= +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O可结合电子得失守恒可得1×n(Fe2+)=5×n(ClO2)+2×3×n(Cr2O72-).与K2Cr2O7反应的n(Fe2+)=6n(Cr2O72-)=6×20×10-3L×0.0500mol/L=6×10-3mol;与ClO2反应的n(Fe2+)=37×10-3L× 0.0500mol/L -6×10-3mol=1.25×10-2mol。所以n(ClO2)=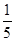 ×1.25×10-2mol=2.5×10-3mol。ClO2的“产率”= ×1.25×10-2mol=2.5×10-3mol。ClO2的“产率”=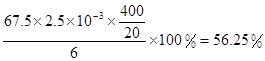 。 。 |
相似问题
下列生活中的化学现象与氧化还原知识有关的是 [ ]A.菜刀洗过后如果没擦干放置一段时间就会
下列生活中的化学现象与氧化还原知识有关的是 [ ]A.菜刀洗过后如果没擦干放置一段时间就会出现斑点 B.用食醋可以洗水垢 C.蔗糖放在水中片刻后消失
已知2MOyx-+5S2-+16H+=2M2+ +5S↓+ 8H2O 则下列选项正确的是A.x=2B
已知2MOyx-+5S2-+16H+=2M2+ +5S↓+ 8H2O,则下列选项正确的是A.x=2B.氧化产物和还原产物的比为2:5C.生成4mol H2O转移10mol电子D.MOyx-中的M的化合价为+7
钨是我国丰产元素。自然界中钨主要以钨(+6)酸盐的形式存在。黑钨矿的主要成分是铁和锰的钨酸盐(FeW
钨是我国丰产元素。自然界中钨主要以钨(+6)酸盐的形式存在。黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4)。黑钨矿传统冶炼工艺流程图如下:(1)已知
向0.1 mol·L-1 NaOH溶液中通入过量CO2后 溶液中存在的主要离子是( )。A.Na+
向0 1 mol·L-1 NaOH溶液中通入过量CO2后,溶液中存在的主要离子是( )。A.Na+、CO32-B.Na+、HCO3-C.HCO3-、CO32-D.Na+、OH-
将足量CO2通入KOH和Ca(OH)2的混合稀溶液中 生成沉淀的物质的量(n)和通入CO2体积(V)
将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系正确的是()












