通过对模型 图形 图表的观察 能获取有关信息是化学学习的一种重要能力。按要求回答下列问题。(1) 现
| 通过对模型、图形、图表的观察,能获取有关信息是化学学习的一种重要能力。按要求回答下列问题。 (1) 现有下列短周期元素性质的部分数据,其中X数值是表示不同元素的原子在分子内吸引电子的能力大小,若X值越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷一方: 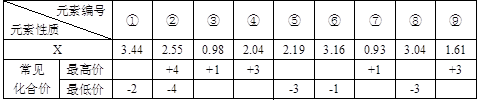 写出下列编号所代表的元素符号:①____,②____,④____,⑤____,⑥____。 (2) 已知4种无机化合物在水中和液氨中的溶解度(g/100g溶剂)为: 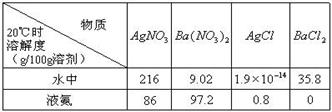 由上表的数据可知,在水溶液中上述化合物发生复分解反应的化学方程式为______________________,在液氨溶液中发生复分解反应的化学方程式为______________________________________________。 (3) 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的物质的量之间的关系如右图所示。三种物质和铁发生反应的顺序为___________,第一步反应的离子方程式为________,由图可知溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为__________。 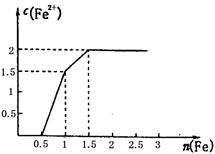 |
参考解答
| (1)(5分,每空1分)O;C;B;P;Cl。 (2)2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2;2AgCl+Ba(NO3)2=2AgNO3+BaCl2↓ (3)HNO3、Fe(NO3)3、Cu(NO3)2; Fe+4H++NO3-=Fe3++NO↑+2H2O ;1:1:4 |
试题分析:(1)根据题意可知若X值越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷一方,这说明X值越大,非金属性越强。①的最低价是-2价,没有最高价,且X值最大,这说明X应该是位于第二周期第ⅥA族的氧元素;②的最高价和最低价分别是+4价和-4价,这说明②是第ⅣA族元素。④和⑨的最高价是+3价,因此是第ⅢA族所以。由于X值是④>⑨,所以④是B,⑨是Al。⑤⑧的最低价均是-3价,说明二者是第ⅤA族所以。由于X值是⑧>⑤,所以⑤是P,⑧N。⑥的最低价是-1价,说明位于第ⅦA族,且X值仅小于氧元素的,因此⑥是氯元素。③⑦的最高价是+1价,说明是第IA族元素。由于X值是③>⑦,所以③是Li,⑦是钠。由于②的X值大于P元素的,而小于N元素的,这说明②元素第二周期的碳元素。 (2)根据物质的溶解度表可分析物质在不同溶剂中的溶解度,再利用复分解反应发生的条件来判断发生的化学反应。因在水中,AgCl的溶解度为1.9×10-4g,则可认为氯化银不溶于水,其它三种物质都能溶于水,因此氯化钡和硝酸银能相互交换成分生成氯化银沉淀而发生了复分解反应,其反应为BaCl2+2AgNO3=Ba(NO3)2+2AgCl↓;在液氨中,BaCl2的溶解度接近0,则可认为氯化钡在液氨中不溶,其它物质都能溶解在液氨中,因此硝酸钡和氯化银能相互交换成分生成氯化钡沉淀而发生复分解反应,其反应为2AgCl+Ba(NO3)2=2AgNO3+BaCl2↓。 (3)稀溶液中各物质的氧化性顺序为HNO3>Fe(NO3)3>Cu(NO3)2,所以加入铁后会依次发生氧化还原反应,①Fe+4H++NO3-=Fe3++NO↑+2H2O;②Fe+2Fe3+=3Fe2+;③Fe+Cu2+=Cu+Fe2+,所以三种物质和铁发生反应的顺序为HNO3、Fe(NO3)3、Cu(NO3)2;从图象中可知铁为0.5mol时,无Fe2+生成,发生的反应是①,消耗硝酸为0.5mol×4=2mol,生成Fe3+0.5mol;再加入0.5mol铁发生反应②,生成Fe2+物质的量为1.5mol,反应的Fe3+物质的量为1mol,其中原溶液中的Fe3+物质的量0.5mol;再加入0.5mol铁发生反应③,此时又生成Fe2+物质的量为0.5mol,说明原溶液中Cu2+物质的量为0.5mol.综上所述可知原溶液中Fe(NO3)3为0.5mol,Cu(NO3)2物质的量为0.5mol,HNO3物质的量为2mol,因此溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为1:1:4。 |
相似问题
已知2Fe2++Br2=2Fe3++2Br-。向100mL的FeBr2溶液中通入标准状况下的Cl2
已知2Fe2++Br2=2Fe3++2Br-。向100mL的FeBr2溶液中通入标准状况下的Cl2 3 36L,充分反应后测得溶液中Cl-与Br-的物质的量浓度相等,则原FeBr2溶液的
(1)(8分)某反应体系中的物质有NaOH Au2O3 Na2S4O6 Au2O H2O Na2S2
(1)(8分)某反应体系中的物质有NaOH、Au2O3,Na2S4O6,Au2O,H2O,Na2S2O3。Au2O3为反应物,回答下列部题A.NaOH是(反应物、生成物)B.Na2S4O6是(
(1小题1分 2 3小题各2分 共5分)用15.8g KMnO4与12mol/L的浓HCl发生。反应
(1小题1分,2、3小题各2分,共5分)用15 8g KMnO4与12mol L的浓HCl发生。反应方程式如下:2KMnO4+ 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑+ 8H
将0.03mol Cl2缓缓通入含0.02mol H2SO3和0.02molHBr的溶液中 在此过程
将0 03mol Cl2缓缓通入含0 02mol H2SO3和0 02molHBr的溶液中,在此过程中,溶液的[H+]与Cl2用量的关系示意图是(溶液的体积视为不变)()
(每格2分 共8分)配平该化学方程式 □K37ClO3 + □H35Cl —□KCl+□Cl2 +□
(每格2分,共8分)配平该化学方程式□K37ClO3 + □H35Cl —□KCl+□Cl2 +□H2O 该反应中HCl体现了_______性,若反应中有1 5mol电子发生转移生成Cl2_












