电解饱和食盐水的反应为2NaCl+2H2OCl2↑+H2↑+2NaOH。27. 在上述方程式上标出电
电解饱和食盐水的反应为2NaCl+2H2O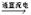 Cl2↑+H2↑+2NaOH。 Cl2↑+H2↑+2NaOH。27. 在上述方程式上标出电子转移的方向和数目。 28. 该反应中被氧化的元素是 。阴极产物之一为H2,阴极上发生的变化为 反应(选填“氧化”、“还原”)。 29. 电解产物氯气既能作氧化剂,也能作还原剂。下列反应中氯气只作氧化剂的是 (填写编号)。 a.Cl2+2KI→2KCl+I2 b.Cl2 + 2NaOH →NaCl + NaClO + H2O c.CuCl2 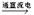 Cl2↑+ Cu d.3Cl2 + 2Fe Cl2↑+ Cu d.3Cl2 + 2Fe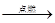 2FeCl3 2FeCl3 |
参考解答
27. 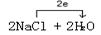 (2分,方向、数目各1分) (2分,方向、数目各1分) 28. Cl(1分) 还原(1分) 29. a、d(2分、选对1个得1分,错选、多选不得分) |
试题分析:27.方程式中Cl从-1→0,失去电子,H从+1→0得到电子,故电子转移的方向Cl→H,数目2e-。 28.反应过程中化合价升高的元素被氧化,该反应中被氧化的元素是Cl。阴极产物之一为H2,H元素化合价降低,阴极上发生的变化为还原反应。 29. 电解产物氯气既能作氧化剂,也能作还原剂。下列反应中氯气只作氧化剂的是 (填写编号)。 a.Cl2+2KI→2KCl+I2,Cl的化合价只降低,Cl2是氧化剂;b.Cl2 + 2NaOH →NaCl + NaClO + H2O Cl的化合价既升高又降低,Cl2既是氧化剂又作还原剂;c.CuCl2 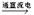 Cl2↑+ Cu,Cl的化合价只升高,Cl2是还原;d.3Cl2 + 2Fe Cl2↑+ Cu,Cl的化合价只升高,Cl2是还原;d.3Cl2 + 2Fe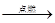 2FeCl3,Cl的化合价只降低,Cl2是氧化剂。 2FeCl3,Cl的化合价只降低,Cl2是氧化剂。 |
相似问题
1.76克铜镁合金完全溶解于50mL 密度为1.40g/cm3 质量分数为63%的浓硝酸中 得到NO
1 76克铜镁合金完全溶解于50mL、密度为1 40g cm3、质量分数为63%的浓硝酸中,得到NO2气体1792mL (标准状况),向反应后的溶液中加入适量的1 0mol LNaOH溶
有关氧化还原反应实质的说法中正确的是[ ]A.是否有元素的电子转移 B.是否有元素的化合价的
有关氧化还原反应实质的说法中正确的是[ ]A.是否有元素的电子转移 B.是否有元素的化合价的变化C.是否有氧元素的参加 D.是否有原子的重新组合
在某100mL混合酸中 HNO3物质的量浓度为0.4mol.L-1 H2SO4物质的量浓度为0.2m
在某100mL混合酸中,HNO3物质的量浓度为0 4mol L-1,H2SO4物质的量浓度为0 2mol L-1。向其中加入足量的铜粉,待充分反应后,溶液中Cu2+物质的量浓度为
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料 二者在自然界中共生。根据题意完成下列填
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2
研究物质间的氧化还原反应有重要的意义。(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制
研究物质间的氧化还原反应有重要的意义。(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是___________;生成0.5molK2Fe












