已知氮元素有许多化合价 其化合价有一3 0 +1 +2 +3 +4 +5(1)下表是硝酸与某种金属M
| 已知氮元素有许多化合价,其化合价有一3、0、+1、+2、+3、+4、+5 (1)下表是硝酸与某种金属M在某些条件下反应所得还原产物的关系: 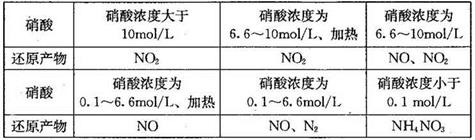 金属锌与某浓度的硝酸反应时,无气体产生,则此化学反应中被还原的硝酸与参加反应的硝酸物质的量之比是____________。 (2)以氨作为燃料的固体氧化物(含有02-)燃料电池,具有全固态结构、能量效率高、无污染等特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体。其工作原理如图所示, 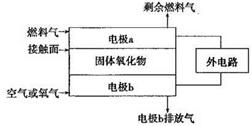 ①该电池工作时的总反应为_______________________ ②固体氧化物作为电池工作的电解质,O2-移动方向为________(选填“由电极a向电极b”或“由电极b向电极a”)。 ③该电池工作时,在接触面上发生的电极反应为________。 (3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。如图所示装置可用于制备N2O5,写出在电解池中生成N2O5的电极反应式________________。 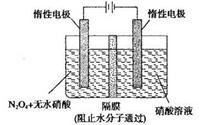 |
参考解答
| (1)1:10 4Zn+10HNO3(稀)=4Zn(NO3) 2+NH4NO3+3H2O。(2)4NH3+3O2=2N2+6H2O.由电极b向电极a(因为阴离子向原电池的负极移动) 2NH3+3O2-+6e-= N2+3H2O (3)N2O4+2HNO3-2e-=2N2O5+2H+。 |
试题分析:(1)金属锌与某浓度的硝酸反应时,无气体产生,说明硝酸被还原产生的氨气被硝酸吸收产生了硝酸铵。反应的化学方程式为:4Zn+10HNO3(稀)=Zn(NO3) 2+NH4NO3+3H2O此化学反应中有10个HNO3参加反应,其中被还原的HNO3是1个。所以被还原的硝酸与参加反应的硝酸物质的量之比是1:10.(2)①该电池工作时的总反应为4NH3+3O2=2N2+6H2O。② 固体氧化物作为电池工作的电解质,O2-会向正电荷较多的负极方向移动。即移动方向为由电极b向电极a。③该电池工作时,在接触面上发生的电极反应为2NH3+3O2-+6e-= N2+3H2O 。(3)用电解法以N2O4和2HNO3为原料,在电解池中生成N2O5的电极反应式N2O4+2HNO3-2e-=2N2O5+2H+。 |
相似问题
将11.9 g由Mg Al Fe组成的合金溶于足量的NaOH溶液中 合金质量减少了2.7 g。另取等
将11 9 g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2 7 g。另取等质量的合金溶于过量稀硝酸中,生成了6 72 L NO(标准状况下),向
单质硫在KOH的热溶液中发生岐化反应:3 S + 6 KOH2 K2S + K2SO3 + 3 H2
单质硫在KOH的热溶液中发生岐化反应:3 S + 6 KOH2 K2S + K2SO3 + 3 H2O若硫过量,进一步生成K2Sx(x ≤ 5)和K2S2O3。将0 08 mol单质硫与
下列有关氧化还原反应叙述正确的是[ ]A.氧化还原反应的本质是化合价发生变化B.有单质产生的
下列有关氧化还原反应叙述正确的是[ ]A 氧化还原反应的本质是化合价发生变化B 有单质产生的分解反应一定是氧化还原反应 C 非金属单质在反应中只可作氧
钛冶炼厂与氯碱厂 甲醇厂组成一个产业链(如图所示) 将大大提高资源的利用率 减少环境污染。请回答下列
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。请回答下列问题:(1)Fe的原子序数为26,其最外层电子数
已知A2On2-可将B2-氧化为B单质 A2On2-则被还原为A3+ 又知100mL的0.3mol/
已知A2On2-可将B2-氧化为B单质,A2On2-则被还原为A3+,又知100mL的0 3mol L的A2On2-与150mL的0 6mol L B2-恰好完全反应,则A2On2-中的n值为 [ ]A.4 B.5 C.6D.7












