(1)在试管里放入一小块铜片 注入一定体积的浓硫酸 给试管加热 使之反应。若铜片还有剩余硫酸是否消耗
| (1)在试管里放入一小块铜片,注入一定体积的浓硫酸,给试管加热,使之反应。若铜片还有剩余硫酸是否消耗完毕? ①结论及理由是:_________________________________________。 ②向100毫升18 mol/L的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量 A.小于0·9 mol B.等于0·9 mol C.在0·9 mol与1.8 mol之间 D.大于1·8 mol ③50g的胆矾加热到100℃失去部分结晶水后,质量变为35.6g,则失去水后的硫酸铜晶体的化学式是 A.CuSO4·H2O B.CuSO4·2H2O C.CuSO4·3H2O D.CuSO4 (2)足量的锌投入到一定量的浓硫酸中,充分反应后共收集到SO2和H222.4L(标准状况)。 ①简述能产生H2的原因是____________ __________________ ②上述变化中体现浓硫酸强氧化性的反应方程式是: ③反应共消耗金属锌的质量为_________g。 ④以上数据能否计算出消耗的硫酸的物质的量? _ (填“能”或“不能”) |
参考解答
| (12分)(1)①否,随反应进行,硫酸浓度不断降低,稀硫酸与铜不反应,所以硫酸会有剩余 ②A ③A (2)①随反应的不断进行,浓硫酸浓度不断降低,与锌稀硫酸反应产生了氢气 ②Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O ③65 ④不能 |
试题分析:(1)①由于随反应进行,硫酸浓度不断降低,稀硫酸与铜不反应,所以硫酸会有剩余。 ②浓硫酸的物质的量是1.8mol,所以根据反应式Cu+2H2SO4(浓) 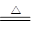 CuSO4+2H2O+SO2↑,并结合①可知,实际被还原硫酸的物质的量小于0.9mol,答案选A。 CuSO4+2H2O+SO2↑,并结合①可知,实际被还原硫酸的物质的量小于0.9mol,答案选A。③50g的胆矾加热到100℃失去部分结晶水后,质量变为35.6g,则失去的水的质量是50g-35.6g=14.4g,物质的量是0.8mol。胆矾的物质的量是0.2mol,共计含有1mol水。这说明反应后含有的水的物质的量水0.2mol,所以化合物的化学式是CuSO4·H2O,答案选A。 (2)①由于随反应的不断进行,浓硫酸浓度不断降低,与锌稀硫酸反应产生了氢气。 ②体现浓硫酸强氧化性的反应方程式是Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O。 ③混合气的物质的量是1mol,由于不论是氢气,还是SO2,在反应中都是转移2个电子的,所以共计电子得失守恒可知,参加反应的锌的物质的量也是1mol,质量是65g。 ④由于不能确定SO2的物质的量,所以无法确定消耗的硫酸的物质的量。 点评:该题是高考中的常见题型,试题综合性强,难易适中。该题在注重对基础性知识考查与训练的同时,主要是侧重培养学生的解题方法与技巧,有利于调动学生的学习兴趣,激发学生的求知欲。该题的关键是理解浓硫酸的化学性质,以及利用好守恒法在化学计算中的重要应用。 |
相似问题
根据下列反应判断有关物质还原性由强到弱的顺序是( )H2SO3+I2+H2O=H2SO4+2H
根据下列反应判断有关物质还原性由强到弱的顺序是()H2SO3+I2+H2O=H2SO4+2HI2FeCl3+2HI=2FeCl2+2HCl+I23FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3A.I-
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH—=Fe3O4+S4O6
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH—=Fe3O4+S4O62-+2H2O,下列说法中,正确的是A.Fe2+和S2O32—都是还原剂B.x=6C.1mol Fe2+被氧
铁溶于一定浓度的硝酸溶液时 发生反应的离子方程式为:aFe+bNO3-+cH+=dFe2++fFe3
铁溶于一定浓度的硝酸溶液时,发生反应的离子方程式为:aFe+bNO3-+cH+=dFe2++fFe3++gNO↑+hNO2↑+kH2O下列有关推断中,不正确的是( )A.2d+
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-=N
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-=NO↑+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的
下列气体溶于水 发生氧化还原反应的是A.SO2溶于水B.NO2溶于水C.CO2溶于水D.NH3溶于水
下列气体溶于水,发生氧化还原反应的是A.SO2溶于水B.NO2溶于水C.CO2溶于水D.NH3溶于水












