(1)在-50℃时 液氨存在如下电离:2NH3?NH4++NH-2 k=2×10-12 液氨的电离达
| (1)在-50℃时,液氨存在如下电离:2NH3?NH4++NH-2,k=2×10-12,液氨的电离达到平衡时,各微粒的浓度大小关系为______,加入NH4Cl固体,K______2×10-12(填“<”、“>”或“=”) (2)已知25℃时Ksp(AgCl)=1.8×10--10,在10mL 0.10mol/L AgNO3溶液中加入10mL0.20mol/LNaCl溶液,充分反应后溶液中的c(Ag+)=______. (3)配平硫酸亚铁加强热制备铁红和生成硫的两种常见氧化物的化学方程式: ______FeSO4
(4)已知氯气能溶于水,溶液呈酸性.如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是______ A.产生气体的体积:①>② B.溶液的pH变化:①减小,②增大 C.电极上析出物质的质量:①>② D.电极反应式:①中阳极 2Cl--2e-?Cl2↑ ②中负极 2H++2e-?H2↑ 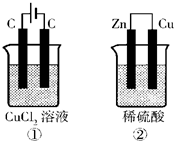 |
参考解答
| 解;(1)在液氨中,存在最多的微粒是液氨分子,由液氨电离出的铵根和亚铵根离子浓度一定是相等的,即c(NH3)>c(NH4+)=c(NH2-), 加入氯化铵固体以后,由于温度不变,所以K不变,故答案为:c(NH3)>c(NH4+)=c(NH2);=; (2)10mL 0.10mol/L AgNO3溶液中加入10mL0.20mol/LNaCl溶液,反应后剩余氯离子的物质的量浓度为
根据氯化银的Ksp=[Ag+[Cl-,则[Cl-=
(3)硫的两种常见氧化物是二氧化硫和三氧化硫,根据原子守恒,则2FeSO4=Fe2O3+SO2↑+SO3↑,故答案为:2;1;1;1; (4)A.①的原理方程式为:CuCl2
②中产生的氢气为0.01mol,产生气体的体积:①=②,故A错误; B.①氯化铜电解实质是电解物质本身,②消耗氢离子,所以酸性溶液的pH变化:①不变,②增大,故B错误; C.当转移电子为0.02mol时,①中阴极上析出金属铜为0.01 mol,即0.64g,②电极上析出氢气0.01mol,即0.02g,所以析出物质的质量:①>②,故C正确; D.电极反应式:①中阳极发生失电子的氧化反应,即2Cl--2e-?Cl2↑,②中负极为金属锌,发生失电子的氧化反应,即Zn-2e-=Zn2+,故D错误. 故选C. |
相似问题
原剂的物质的量之比为5∶2。则n的值是 A.1B
原剂的物质的量之比为5∶2。则n的值是A.1B.2C.3D.4
(4分)长期以来 人们一直认为氟的含氧酸不存在 自1971年美国科学家用F2通过细冰末获得HFO以来
(4分)长期以来,人们一直认为氟的含氧酸不存在,自1971年美国科学家用F2通过细冰末获得HFO以来,对HFO的研究引起了充分重视。(1)HFO的化学名称为(2
将下列5种物质:N2O FeSO4 Fe(NO3)3 HNO3和Fe2(SO4)3分别填入下面对应的
将下列5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上 _____ + ____ → _______ + _______ + _______+H2O组成一
将4.6g金属钠投入到95.6g水中 计算所得溶液中溶质的质量分数?
将4 6g金属钠投入到95 6g水中,计算所得溶液中溶质的质量分数?
Cu2S和稀HNO3反应生成Cu(NO3)2 H2SO4 NO和H2O 试解答下列各题(1)用双线桥
Cu2S和稀HNO3反应生成Cu(NO3)2、H2SO4、NO和H2O,试解答下列各题(1)用双线桥法标出电子转移的方向和数目 3Cu2S+22HNO3=6Cu(NO3)2+3H2SO4+10NO↑+8H2O












