已知将盐酸滴入酸性高锰酸钾溶液中 产生黄绿色气体 而溶液的紫红色褪去.现有一个氧化还原反应的体系中共
| 已知将盐酸滴入酸性高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去.现有一个氧化还原反应的体系中共有HCl、Cl2、H2O、KMnO4、MnCl2、KCl六种物质: (1)写出一个包含上述六种物质的配平的氧化还原反应方程式,并用单线桥标出电子转移方向和数目:______. (2)上述反应中,氧化剂是______,1mol氧化剂在反应中得到的电子数目为______;生成的氧化产物的物质的量为______. (3)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色.说出NaBiO3的一个性质:______. |
参考解答
(1)化合价升高元素是氯元素,在反应中共失去电子10mol,化合价降低元素是锰元素,在反应中共得到电子10mol,氧化还原反应中转移的电子数目为10mol,所以: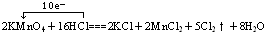 ,故答案为: ,故答案为: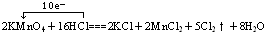 ; ;(2)化合价降低的元素是锰元素,所在反应物KMnO4是氧化剂,消耗2molKMnO4转移10mol的电子,得到氧化产物氯气5mol,所以1mol氧化剂KMnO4在反应中得到5mol电子,即5NA个,生成氯气2.5mol,故答案为:KMnO4;5NA;2.5mol; (3)在反应后的溶液中加入NaBiO3,溶液又变紫红色,说明锰离子成为高锰酸根,所以NaBiO3具有强氧化性,能将锰离子氧化,故答案为:NaBiO3具有强氧化性(比KMnO4氧化性强). |
相似问题
本世纪是生命科学研究的昌盛时期 科学家研究发现 进入生物体内的氧分子 可接受1个电子转变为超氧阴离子
本世纪是生命科学研究的昌盛时期,科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基。一
市售的食品包装中常带有一小包铁粉 并标有“吸氧剂”字样 这是利用了铁粉的A.氧化性B.还原性C.吸水
市售的食品包装中常带有一小包铁粉,并标有“吸氧剂”字样,这是利用了铁粉的A.氧化性B.还原性C.吸水性D.导电性
某校化学研究性学习小组查阅资料了解到以下内容:乙二酸(HOOC-COOH 可简写为H2C2O4)俗称
某校化学研究性学习小组查阅资料了解到以下内容:乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳
(4分)利用氧化还原反应原理配平⑴ NH3 + O2 NO + H2O
(4分)利用氧化还原反应原理配平⑴ NH3 + O2NO + H2O ⑵ FeSO4 + KNO3 + H2SO4 = K2SO4 + Fe2(SO4)3 + NO↑+ H2O
下列标明的电子转移情况哪些是正确的?哪些是错误的?对错误的予以改正。
下列标明的电子转移情况哪些是正确的?哪些是错误的?对错误的予以改正。












