某校化学研究性学习小组查阅资料了解到以下内容:乙二酸(HOOC-COOH 可简写为H2C2O4)俗称
| 某校化学研究性学习小组查阅资料了解到以下内容: 乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验: (1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为 ; (2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去;①说明乙二酸具有 (填“氧化性”、“还原性”或“酸性”);②请配平该反应的离子方程式: MnO4-+ H2C2O4+ H+= Mn2++ CO2↑+ H2O (3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出): 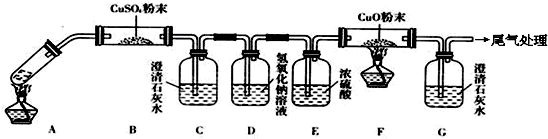 实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红.据此回答: ①上述装置中,D的作用是 , ②乙二酸分解的化学方程式为 ; (4)该小组同学将2.52g草酸晶体(H2C2O4?2H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是 (用文字简单表述),该溶液中各离子的浓度由大到小的顺序为: (用离子符号表示). |
参考解答
答案:(1)HCO3-+H2C2O4=HC2O4-+CO2↑+H2O;
(2)①还原性;②2;5;6;2;10;8;
(3)①除去混合气体中的CO2;②H2C2O4![]() H2O+CO↑+CO2↑
H2O+CO↑+CO2↑
(4)反应所得溶液为NaHC2O4溶液,由于HC2O4-的电离程度比水解程度大,导致溶液中c(H+)>c(OH-),所以溶液呈酸性;Na+>HC2O4->H+>C2O42->OH-.
解析:(1)题中强调足量的草酸,故反应后草酸转化为HC2O4-,且酸性强于碳酸,
反应的离子方程式为HCO3-+H2C2O4=HC2O4-+CO2↑+H2O,故答案为:HCO3-+H2C2O4=HC2O4-+CO2↑+H2O;
(2)①向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明具有氧化性的高锰酸钾被还原,说明草酸具有还原性,把MnO4-还原为Mn2+,故答案为:还原性;
②反应中根据氧化剂得失电子守恒可知氧化剂和还原剂物质的量之间的关系为:2MnO4-~5H2C2O4,在根据电荷守恒和质量守恒可写出反应方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故答案为:2;5;6;2;10;8;
(3)①乙二酸分解的化学方程式为H2C2O4![]() H2O+CO↑+CO2↑,由各物质的性质可推测B中CuSO4固体检验草酸分解产物中的水,C装置检验草酸分解产物中的CO2,D装置的目的是为了除尽CO2,防止影响后续实验现象的判断,E装置用来干燥气体,F、G装置用来判断草酸分解产物中有无CO生成,故答案为:除去混合气体中的CO2;
H2O+CO↑+CO2↑,由各物质的性质可推测B中CuSO4固体检验草酸分解产物中的水,C装置检验草酸分解产物中的CO2,D装置的目的是为了除尽CO2,防止影响后续实验现象的判断,E装置用来干燥气体,F、G装置用来判断草酸分解产物中有无CO生成,故答案为:除去混合气体中的CO2;
②根据题意知草酸分解生成一氧化碳、二氧化碳和水,反应方程式为H2C2O4![]() H2O+CO↑+CO2↑,
H2O+CO↑+CO2↑,
故答案为:H2C2O4![]() H2O+CO↑+CO2↑;
H2O+CO↑+CO2↑;
(4)两者正好1:1反应生成NaHC2O4,溶液显酸性说明HC2O4-的电离程度大于其水解程度,而溶液中还存在着水的电离,故H+>C2O42-,由于离子的电离程度较小,则有HC2O4->H+,故正确顺序为Na+>HC2O4->H+>C2O42->OH-,
故答案为:反应所得溶液为NaHC2O4溶液,由于HC2O4-的电离程度比水解程度大,导致溶液中c(H+)>c(OH-),所以溶液呈酸性;Na+>HC2O4->H+>C2O42->OH-.
相似问题
(4分)利用氧化还原反应原理配平⑴ NH3 + O2 NO + H2O
(4分)利用氧化还原反应原理配平⑴ NH3 + O2NO + H2O ⑵ FeSO4 + KNO3 + H2SO4 = K2SO4 + Fe2(SO4)3 + NO↑+ H2O
下列标明的电子转移情况哪些是正确的?哪些是错误的?对错误的予以改正。
下列标明的电子转移情况哪些是正确的?哪些是错误的?对错误的予以改正。
氯酸是一种强酸 浓度超过40%时会发生分解 反应可表示为:aHClO3=bO2↑+cCl2↑+dHC
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪
已知氧化性:Cl2>>Fe3+>I2 以下实验的结论或实验的预测合理的是A.往溶液中加入过量的氯水再
已知氧化性:Cl2>>Fe3+>I2,以下实验的结论或实验的预测合理的是A.往溶液中加入过量的氯水再加淀粉,振荡不出现蓝色,说明没有I-B.向FeCl2溶液中
已知铜在常温下能被稀硝酸溶解 其反应的化学方程式如下:3Cu+8HNO3══3Cu(NO3)2+2N
已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:3Cu+8HNO3══3Cu(NO3)2+2NO↑+4H2O(1)用单线桥法分析上述反应。_________________________(












