有时候 将氧化还原方程式拆开写成两个“半反应”。下面是一个“半反应”式:( )+( )H
| 有时候,将氧化还原方程式拆开写成两个“半反应”。下面是一个“半反应”式: ( ) 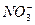 +( )H++( )e-="===( " )NO+( )H2O,该式的配平系数是( ) +( )H++( )e-="===( " )NO+( )H2O,该式的配平系数是( )
|
参考解答
| D |
本题灵活考查了氧化还原反应中的守恒观。氧化还原反应中遵循质量守恒,得失电子守恒。半反应也不例外。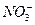 中的N元素由+5价降至+2价,需得到3个电子,再由O元素守恒可确定答案为D。做好此题可为以后书写电化学中的半极反应打好基础。 中的N元素由+5价降至+2价,需得到3个电子,再由O元素守恒可确定答案为D。做好此题可为以后书写电化学中的半极反应打好基础。 |
相似问题
已知2KClO3+I2=2KIO3+Cl2 下列对此反应的说法不正确的是 A.氧化产物与还原产物的物
已知2KClO3+I2=2KIO3+Cl2,下列对此反应的说法不正确的是 A.氧化产物与还原产物的物质的量比为2︰1B.若在标准状况下产生11 2 LCl2,转移电子的物
已知氨气跟氯气可迅速反应生成氯化铵和氮气。当转移的电子总数为a个时 生成的氮气的物质的量bmol.
已知氨气跟氯气可迅速反应生成氯化铵和氮气。当转移的电子总数为a个时,生成的氮气的物质的量bmol (1)写出该反应配平的化学方程式:(2)该反应中参加
已知双氧水仅发生:H2O2O2。等物质的量浓度 等体积的氯化亚铁溶液 亚硫酸钠溶液 双氧水溶液 KI
已知双氧水仅发生:H2O2O2。等物质的量浓度、等体积的氯化亚铁溶液、亚硫酸钠溶液、双氧水溶液、KI溶液,分别与足量的同浓度的酸性高锰酸钾溶液反应,消
(4分)过量铁粉与稀硝酸反应的方程式为: Fe+HNO3(稀)→Fe(NO3)2+NO↑+H2O(1
(4分)过量铁粉与稀硝酸反应的方程式为: Fe+HNO3(稀)→Fe(NO3)2+NO↑+H2O(1)请写出上述反应配平的离子方程式;(2)标准状况下,当生成2 24L
我国目前使用碘酸钾作为食用盐中碘强化剂.并规定 食用盐碘含量的平均水平(以碘元素计)为20mg/kg
我国目前使用碘酸钾作为食用盐中碘强化剂.并规定,食用盐碘含量的平均水平(以碘元素计)为20mg kg~30mg kg.(1)碘酸钾与碘化钾在酸性条件下发生如下












