(14分 每空2分) 硫酸亚铁容易被氧化 而硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O
(14分,每空2分) 硫酸亚铁容易被氧化,而硫酸亚铁 铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀) 铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀)FeSO4+(NH4)2SO4+6H2O  O O步骤l:在盛有适量铁屑的锥形瓶里加入某种试剂除去油污,加热,充分反应后过滤、 洗涤、干燥、称量,铁屑质量为 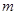 。 。步骤2:将处理过的铁屑加入到一定量的稀H2SO4中,加热至50℃—80℃充分反应, 趁热过滤并用少量热水洗涤,滤液及洗涤液都转移至蒸发皿中。滤渣干燥后称重,剩余铁屑质量为 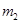 。 。步骤3:准确称取所需质量的硫酸铵晶体加入“步骤2”的蒸发皿中,搅拌  使之溶解, 使之溶解,缓缓加热一段时间,将其冷却结晶、过滤。用无水乙醇洗涤晶体并自然干燥,称量所  得晶体质量为 得晶体质量为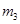 。 。回答下列问题: (1)能够用于除去铁屑表面油污的试剂是 (填字母)。
(3)硫酸亚铁在潮湿的空气中易被氧化生成一种物质  (碱式硫酸铁),该反应的化学方程式为 。 (碱式硫酸铁),该反应的化学方程式为 。(4)铁屑表面常有少量的铁锈(Fe2O3· 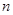 H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。 H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。(5)若忽略铁锈的影响,上述实验中硫酸亚铁铵  晶体的产率为 晶体的产率为  。 。(6)请设计一个简单的实验,检验硫酸亚铁铵晶体中含有结晶水(简述实验操作、现象和结论) 。 |
参考解答
 |
| 略 |
相似问题
关于反应K37ClO3+6H35Cl=KCl+3Cl2↑+3H2O的有关叙述中 正确的是( )A
关于反应K37ClO3+6H35Cl=KCl+3Cl2↑+3H2O的有关叙述中,正确的是()A.KCl中含有35ClB.KCl中含有37ClC.生成物Cl2的相对分子质量大于71D.该反应转移的电子数为6e-
(10分)氧化还原反应在农业生产中和日常生活中有广泛的运用。(1)人通过呼吸作用吸入氧气 氧化体内的
(10分)氧化还原反应在农业生产中和日常生活中有广泛的运用。(1)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6),提供能量以维持生命活动,反
(9分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂 主要用于水的消毒以及砂糖的漂白剂和杀菌。以下
(9分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖的漂白剂和杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图:已知:NaOH
在CS2溶剂中 加入碘和过量的白磷(P4)反应 只生成四碘化二磷。反应后蒸出CS2 固体物质为四碘化
在CS2溶剂中,加入碘和过量的白磷(P4)反应,只生成四碘化二磷。反应后蒸出CS2,固体物质为四碘化二磷和过量的P4,加入适量水到固体物中反应,生成磷酸
.反应的叙述中 正确的是A.氧化剂是SiO2B.氧化剂与还原剂的物质的量之比为1:2C.碳在反应中只
反应的叙述中,正确的是A.氧化剂是SiO2B.氧化剂与还原剂的物质的量之比为1:2C.碳在反应中只做还原剂D.若生成lmolSiC转移电子为2mol












