(12分)过量铁粉与稀硝酸反应的方程式为:3Fe + 8HNO3 (稀)='=' 3Fe(NO3)&
| (12分)过量铁粉与稀硝酸反应的方程式为: 3Fe + 8HNO3 (稀)="=" 3Fe(NO3)2 + 2NO↑ + 4H2O, ①标出电子转移的方向和数目 ②该反应的氧化剂是 ,还原产物是 ; ③标准状况下,当生成2.24L NO气体时, 有 g Fe参加反应,转移电子的物质的量为 ,有 mol氧化剂被还原。 |
参考解答
| (12分) .① 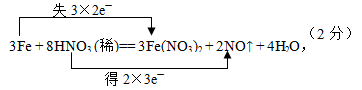 (2分) (2分)② HNO3,NO(各2分) ③8.4,0.3mol,0.1 (各2分) |
| (1)从反应方程观察,Fe变成Fe2+,失去电子总数为3×2e-,硝酸中的N元素由+5价被还原成+2价,从产物上观察,8mol硝酸只有2mol硝酸得到电子被还原,所以得电子总数为2×3e-。 (2)反应中得电子的物质是氧化剂,氧化剂得电子后生成的物质称为还原产物,所以该反应的氧化剂是 HNO3,还原产物为NO。 (3)生成2.24L NO说明HNO3 得到0.3mole-,转移电子数也就是0.3mol,而唯一提供电子的还原剂Fe要提供0.3mol电子,需要0.15molFe,质量为0.15mol×56g/mol=8.4g,最后根据N元素守恒,还原产物NO中的N元素物质的量应该等于被还原的硝酸的物质的量,所以有0.1mol氧化剂被还原. |
相似问题
8NH3 + 3Cl2 ='=' 6NH4Cl + N2的反应中 若有8 mol的NH3被氧化 则A
8NH3+ 3Cl2= "= " 6NH4Cl + N2的反应中,若有8 mol的NH3被氧化,则A.有3 mol Cl2被还原B.氧化产物为1 molC.氧化产物为8 molD.生成N24 mol
(10分)(1)已知下列变化过程中 0.2 mol R2O72-与0.2 mol K2SO3恰好反应
(10分)(1)已知下列变化过程中,0 2 mol R2O72-与0 2 mol K2SO3恰好反应,则R被还原的价态为____。(2)在100 mL 0 100 mol·L-1的FeBr2溶液中通入C
对于反应3Cl2+6NaOH5NaCl+NaClO3+3H2O 以下叙述正确的是( )A.C
对于反应3Cl2+6NaOH5NaCl+NaClO3+3H2O,以下叙述正确的是()A.Cl2是氧化剂,NaOH是还原剂B.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1C.Cl2
24mL 0.05mol/L的Na2SO3溶液 恰好与20mL0.02mol/L的K2Cr2O7溶液
24mL 0 05mol L的Na2SO3溶液,恰好与20mL0 02mol L的K2Cr2O7溶液完全反应,Na2SO3生成Na2SO4,则铬元素在还原产物中的化合价为()A.+6B.+2C.+3D.0
下列反应不属于氧化反应的是A.乙醇在铜做催化剂 加热条件下与氧气反应生成乙醛B.乙烯 乙醇分别使酸性
下列反应不属于氧化反应的是A.乙醇在铜做催化剂、加热条件下与氧气反应生成乙醛B.乙烯、乙醇分别使酸性高锰酸钾溶液褪色C.苯在浓硫酸做催化剂、加热条












