(6分)将32g铜与250mL一定浓度的硝酸恰好完全反应 产生的NO和NO2混合气体在标准状况下的体
| (6分)将32g铜与250mL一定浓度的硝酸恰好完全反应,产生的NO和NO2混合气体在标准状况下的体积为11.2L。试计算 (1)被还原的HNO3的物质的量 mol (2)若反应后体积不变,溶液的物质的量浓度为 (3)NO的体积为 |
参考解答
| (1)0.5 ; (2)2mol?L ̄1; (3)5.6L |
硝酸属于氧化性酸可将铜氧化成硝酸铜,而自身被还原成NO或NO2。根据N原子守恒可知被还原的HNO3的物质的量就是还原产物NO和NO2的物质的量之和,即为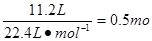 ;由铜原子守恒可知氧化产物硝酸铜的物质的量为 ;由铜原子守恒可知氧化产物硝酸铜的物质的量为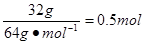 ,因此溶液的物质的量浓度为 ,因此溶液的物质的量浓度为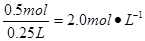 ;若设NO和NO2的物质的量分别为X和Y,则由得失电子守恒可知①0.5mol×2=3X+Y,又因为②X+Y=0.5mol,由①②可计算出X和Y分别为0.25mol和0.25mol,所以在标准状况下NO的体积为0.25mol×22.4L?mol-1=5.6L。 ;若设NO和NO2的物质的量分别为X和Y,则由得失电子守恒可知①0.5mol×2=3X+Y,又因为②X+Y=0.5mol,由①②可计算出X和Y分别为0.25mol和0.25mol,所以在标准状况下NO的体积为0.25mol×22.4L?mol-1=5.6L。 |
相似问题
在2KMnO4 + 16HCl ='==' 2KCl+2MnCl2十5C12↑+8H2O反应中。(1
在2KMnO4+ 16HCl = "== " 2KCl+2MnCl2十5C12↑+8H2O反应中。(1)在上述反应式用双线桥法标明电子转移的方向和数目。(2若有7 3g HCl被氧化,产生C12的质量为多少克?
某反应中有六种微粒:Co2O3 H2O Cl2 H+ Cl—和Co2+ 已知氧化性:Co2O3>Cl
某反应中有六种微粒:Co2O3、H2O、Cl2、H+、Cl—和Co2+,已知氧化性:Co2O3>Cl2。下列叙述不正确的是( )A.氧化产物为Cl2B.微粒的还原性Cl—>Co2+C.氧
由KClO3与MnO2混合加热 把所得固体加水溶解 过滤后 用硝酸酸化的AgNO3溶液检验滤液中含有
由KClO3与MnO2混合加热,把所得固体加水溶解、过滤后,用硝酸酸化的AgNO3溶液检验滤液中含有Cl-,此过程所发生的反应类型不包含 ( )A.化合反应B.分解
(4分)在Fe3O4 +4CO3Fe+4CO2的的中 是氧化剂
(4分)在Fe3O4 +4CO3Fe+4CO2的的中,是氧化剂,是还原剂,元素被氧化,元素被还原。
在反应2KMnO4+16HCl2KCl+2MnCl2+5Cl2↑+8H2O反应中 氧化剂是
在反应2KMnO4+16HCl2KCl+2MnCl2+5Cl2↑+8H2O反应中,氧化剂是,氧化产物是;若有1mol KMnO4参加反应时,该反应转移电子的个数是;若反应生成11 2LCl2(标












