将一铝片投入500mL 3mol/L的H2SO4溶液中.(1)写出所发生反应的化学方程式并用双线桥
| 将一铝片投入500mL 3mol/L的H2SO4溶液中. (1)写出所发生反应的化学方程式并用双线桥分析电子转移的方向和数目. (2)当生成11.2L(标准状况下)H2时,求此时溶液中H+的物质的量浓度.(假设溶液体积仍为500mL) |
参考解答
| (1)反应中Al的化学键由0价升高为+3价,H元素的化合价由+1价降低到0价,氧化剂为H2SO4,还原剂为Al, 用双线桥法可表示如下: 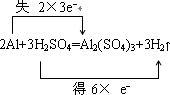 答:  ; (2)n(H2SO4)=0.5L×3mol/L=1.5mol,n(H2)=
2Al+3H2SO4=Al2(SO4)3+3H2↑ 0.5mol 0.5mol 所以剩余硫酸的物质的量为1.5mol-0.5mol=1mol, 则:反应后溶液中n(H+)=2mol c(H+)=
答:溶液中H+的物质的量浓度为4mol/L. |
相似问题
某一反应体系有反应物和生成物共五种物质:O2 H2CrO4 Cr(OH)3 H2O H2O2.已知该
某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2.已知该反应中H2O2只发生如下过程:H2O2→O2.请回答:(1)该反应中的还原
ClO2是一种消毒杀菌效率高 二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O下列说法不正确的是(
下列说法正确的是( )A.反应中某元素化合价升高 则该元素被还原B.从海水中提取溴元素(以Br-形
下列说法正确的是( )A.反应中某元素化合价升高,则该元素被还原B.从海水中提取溴元素(以Br-形式存在),可以考虑向其中通入F2C.在偏远的地区,
A B C D E五种短周期元素的原子序数依次增大 且已知:①其原子半径的大小关系是:D>E>B>C
A、B、C、D、E五种短周期元素的原子序数依次增大,且已知:①其原子半径的大小关系是:D>E>B>C>A;②A、D同主族,可形成离子化合物;③B、D、E三者的
下列反应既属于氧化还原反应 又是吸热反应的是( )A.锌与硫酸铜溶液反应B.灼热的木炭与H2O的反
下列反应既属于氧化还原反应,又是吸热反应的是( )A.锌与硫酸铜溶液反应B.灼热的木炭与H2O的反应C.Ca(OH)2与NH4HCO3的反应D.固体NH4NO3溶入水中












