已知A B C D E F G七种元素 G原子核外有四个电子层 其余原子至多只有三个电子层 且原子序
已知A、B、C、D、E、F、G七种元素,G原子核外有四个电子层,其余原子至多只有三个电子层,且原子序数依次递增.A、B、F位于周期表的s区,A原子中电子层数和未成对电子数相同,B和A同族且位于A的下一周期,C元素基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,E的基态原子核外成对电子数是未成对电子数的3倍,F与E不同周期且F在其周期中的电负性最大,G原子d轨道有7个电子. 请回答下列问题: (1)G基态原子的核外电子排布式是 ; (2)C、D、E的第一电离能由大到小的顺序是: (3)下列有关上述元素的说法中,不正确的是 (填字母) a.B单质的熔点在同族单质中最高 b.1mol A 2E的晶体中含有4mol氢键 c.SiO44-与FE4-互为等电子体 d.C3 A6直链分子中C原子采取sp、sp3两种杂化方式 (4)ACD分子中含 个σ键。 (5)GCl3能与NH3反应形成一种六配位的配合物,两个氯离子位于外界,则该配合物的化学式为 ; (6)C的单质是一种层状结构,B的离子位于C单质的层间、其投影位于层面内六圆环的中央,B和C 形成一种化合物,“?”表示B离子的位置,平行四边形表示在此二维图形上画出的一个晶胞.则该化合物的化学式为 。 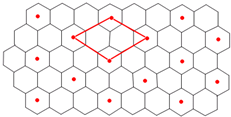 |
参考解答
| (1)1s22s22p63s23p63d74s2 (2)D>E>C (3)bd (4)2 (5)[CoCl(NH3)5Cl2 (6)LiC6 |
| A、B、C、D、E、F、G七种元素,G原子核外有四个电子层,其余原子至多只有三个电子层,且原子序数依次递增.A、B、F位于周期表的s区,A原子中电子层数和未成对电子数相同,且属于S区,原子序数最小,则A是H元素,B和A同族且位于A的下一周期,则B是Li元素,C元素基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则C是C元素;E的基态原子核外成对电子数是未成对电子数的3倍,E是O元素,则D是N元素,F与E不同周期且F在其周期中的电负性最大,则F是Cl元素,G原子d轨道有7个电子,则G是Ni元素。 (1)G是钴元素,其核外有27个电子,根据构造原理知,其核外电子排布式为:1s22s22p63s23p63d74s2。 (2)C是C元素,D是N元素,E是O元素,同一周期元素,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第VA族元素第一电离能大于第VIA族元素,所以C、N、O的第一电离能大小顺序是:D>E>C。 (3)a.碱金属族元素单质的熔点随着原子序数的增大而减小,所以Li单质的熔点在同族单质中最高,故正确; b.1molH2O的晶体中含有2mol氢键,故错误; c.SiO44-与ClO4-互为原子个数和价电子数相等,所以是等电子体,故正确; d.C3H6直链分子中,甲基上C原子采取sp3杂化,碳碳双键两端的碳原子采用sp2杂化,故错误;故选b d; (4)HCN分子的结构简式为:H-C≡N,所以HCN中含有2个??键,。 (5)CoCl3能与NH3反应形成一种六配位的配合物,两个氯离子位于外界,则一个氯原子位于內界,其配位数是6,则该配合物还含有5个氨气分子位于內界,所以该配合物的化学式为[CoCl(NH3)5Cl2。 (6)C的单质是一种层状结构,Li的离子位于C单质的层间、其投影位于层面内六圆环的中央,Li和C 形成一种化合物,“?”表示B离子的位置,该晶胞中锂离子个数=4×1/4=1,碳原子个数=2+8×1/2=6,所以其化学式为:LiC6。 |
相似问题
W X Y Z是四种常见的短周期主族元素 其原子半径随原子序数的变化如图所示。已知Y Z两种元素的单
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示。已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的
对于元素周期表 下列叙述中不正确的是( )A.在金属元素与非金属元素的分界线附近可以寻找制备
对于元素周期表, 下列叙述中不正确的是()A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素B.在过渡元素中可以寻找制备催化剂及耐
已知短周期元素甲 乙 丙 丁 戊的原子序数依次增大 其氢化物中甲 乙 丙 丁 戊的化合价如下 下列说
已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,其氢化物中甲、乙、丙、丁、戊的化合价如下,下列说法不正确的是元素甲乙丙丁戊化合价-3-2+1-
已知元素X Y的核电荷数分别是a和b 它们的离子Xm +和Yn - 的核外电子排布相同 则下列关系式
已知元素X、Y的核电荷数分别是a和b,它们的离子Xm +和Yn - 的核外电子排布相同,则下列关系式正确的是( )A.a = b+m+nB.a = b-m+nC.a = b+m-nD.a=b-m-n
元素的性质呈周期性变化的根本原因是( )A.元素的原子半径呈周期性变化B.元素原子量的递增
元素的性质呈周期性变化的根本原因是( )A.元素的原子半径呈周期性变化B.元素原子量的递增,量变引起质变C.元素的金属性和非金属性呈周期性变化D.元












