过碳酸钠是一种有多用途的新型氧系漂白剂 化学式可表示为aNa2CO3·bH2O2。现将一定质量的过碳
过碳酸钠是一种有多用途的新型氧系漂白剂,化学式可表示为aNa2CO3·bH2O2。现将一定质量的过碳酸钠粉末溶于水配成稀溶液,再向其中加入适量MnO2粉末,充分反应后生成672mL气体(标准状况)。反应后的混合物经过滤、洗涤后,将滤液和洗涤液混合并加水配成100mL溶液A。现向三份体积为10mL、浓度为cmol/L的稀硫酸中分别逐滴滴入溶液A,边滴边振荡,充分反应后,测得实验数据如下表所示:
⑴稀硫酸的物质的量浓度c= mol/L。 ⑵计算确定过碳酸钠的化学式。 ⑶工业上常以所含活性氧的质量分数[w(活性氧)= 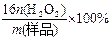 ]来衡量过碳酸钠产品的优劣,13%以上者为优等品。 ]来衡量过碳酸钠产品的优劣,13%以上者为优等品。现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na2S2O3溶液滴定到蓝色恰好消失时,共消耗33.00mL,试计算判断该样品是否为优等品。(已知:2Na2S2O3+I2=Na2S4O6+2NaI) |
参考解答
| ⑴0.5 ⑵2Na2CO3·3H2O2 ⑶该过碳酸钠样品为优等品。 |
| ⑴对表中实验数据分析,Ⅲ中稀硫酸完全反应,运用该数据计算 ⑵n(O2)= 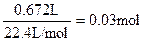 n(H2O2)=0.06mol 由实验Ⅰ中数据可知,5mLA溶液中: n(Na2CO3)=n(CO2)= 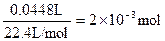 所以100mLA中含有 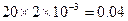 mol moln(Na2CO3) ∶ n(H2O2)=0.04:0.06=2:3 所以化学式为2Na2CO3·3H2O2 ⑶据题意可得: n(H2O2)= n(Na2S2O3) /2=0.1mol/L×0.033L/2=1.65×10-3mol 该过碳酸钠的活性氧的质量分数为: 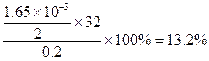 >13% >13% |
相似问题
关于Li的结构和性质的判断 错误的是( )A.与水反应比钠剧烈B.它的原子半径比钠小C.它的
关于Li的结构和性质的判断,错误的是( )A.与水反应比钠剧烈B.它的原子半径比钠小C.它的氧化物暴露在空气中易吸收CO2D.它的阳离子的最外层
把一瓶不饱和的烧碱溶液分成三等份 保持温度不变 向三份溶液中分别加入一定量的NaOH Na2O2 N
把一瓶不饱和的烧碱溶液分成三等份,保持温度不变,向三份溶液中分别加入一定量的NaOH、Na2O2、Na2O,使溶液均恰好饱和。下列叙述不合理的是()A.加入
下图中A至F是化合物 G是单质。 写出A B E F的化学式:A____ B____ E__
下图中A至F是化合物,G是单质。写出A、B、E、F的化学式:A____, B____, E____, F____。
下列有关热稳定性的强弱比较 不正确的是( )A.Na2O2>Na2OB.NaHCO3<Na2CO3C
下列有关热稳定性的强弱比较,不正确的是()A.Na2O2>Na2OB.NaHCO3<Na2CO3C.KClO3>KClD.K2MnO4>KMnO4
1 mol过氧化钠与2 mol碳酸氢钠固体混合物 在密闭容器中加热充分反应 排出气体物质后冷却 残留
1mol过氧化钠与2mol碳酸氢钠固体混合物,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 [ ]A.Na2CO3 B.Na2O2Na2CO3 C.NaOHNa2CO3 D.Na2O2NaOHNa2CO3












