过氧化钠(Na2O2)是一种淡黄色固体.某化学兴趣小组的同学将包有Na2O2固体的棉花放入图甲烧杯中
过氧化钠(Na2O2)是一种淡黄色固体.某化学兴趣小组的同学将包有Na2O2固体的棉花放入图甲烧杯中,缓慢倒入CO2后发现处于下面的蜡烛线熄灭,上面的后熄灭,同时也惊奇地发现棉花燃烧起来.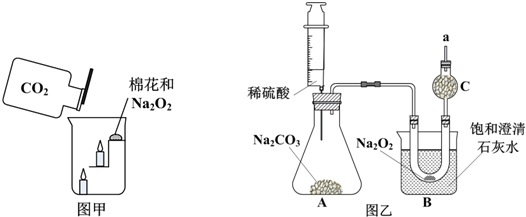 Ⅰ.实验中“下面的蜡烛线熄灭,上面的后熄灭”的现象说明二氧化碳具有______的性质. Ⅱ棉花为什么会燃烧呢?经过讨论后,该小组同学设计了如图乙的实验进行探究. 实验现象: ①一段时间后,在处放置一根带火星的小木条,小木条复燃; ②B中盛饱和的澄清石灰水的烧杯中出现白色不溶物. 分析并回答下列问题: (1)A中发生反应的化学方程式为______; (2)B中U形管内发生反应的化学方程式______; (3)B装置的烧杯内出现白色不溶物的原因是______; (4)“小木条复燃”说明Na2O2和CO2反应产生了______,“饱和的澄清石灰水变浑浊”说明Na2O2和CO2反应要______(填“吸收”或“放出”)热量,使棉花具备了燃烧条件. |
参考解答
| Ⅰ、下面的蜡烛线熄灭,上面的后熄灭,说明二氧化碳比空气重,不燃烧也不支持燃烧, 故答案为:不燃烧且不支持燃烧,且密度比空气的密度大; Ⅱ、(1)依据装置图和题干信息分析,A中是碳酸钠和硫酸的反应,反应的化学方程式为:Na2CO3+H2SO4=Na2SO4+CO2↑+H2O, 故答案为:Na2CO3+H2SO4=Na2SO4+CO2↑+H2O; (2)在常温下Na2O2和CO2能发生化学反应,生成氧气,使带火星的木条复燃;并放出大量的热,溶液温度升高,氢氧化钙的溶解度减小,有固体析出,所以烧杯内的澄清石灰水变浑浊,B中U形管内为过氧化钠和二氧化碳的反应,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2, 故答案为:2Na2O2+2CO2=2Na2CO3+O2; (3)在常温下Na2O2和CO2能发生化学反应,并放出大量的热,溶液温度升高,氢氧化钙的溶解度减小,有固体析出,所以烧杯内的澄清石灰水变浑浊, 故答案为:溶液温度升高,氢氧化钙的溶解度减小,有固体析出; (4)“小木条复燃”说明过氧化钠和二氧化碳反应产生氧气;根据实验装置和实验现象可知:根据氢氧化钙的溶解度随温度的升高而降低,饱和的澄清石灰水变浑浊说明反应一定放出热量;所以反应放出热量,温度升高后,氢氧化钙的溶解度降低,析出固体, 故答案为:氧气;放热. |
相似问题
过碳酸钠是一种有多用途的新型氧系漂白剂 化学式可表示为aNa2CO3·bH2O2。现将一定质量的过碳
过碳酸钠是一种有多用途的新型氧系漂白剂,化学式可表示为aNa2CO3·bH2O2。现将一定质量的过碳酸钠粉末溶于水配成稀溶液,再向其中加入适量MnO2粉末,充
关于Li的结构和性质的判断 错误的是( )A.与水反应比钠剧烈B.它的原子半径比钠小C.它的
关于Li的结构和性质的判断,错误的是( )A.与水反应比钠剧烈B.它的原子半径比钠小C.它的氧化物暴露在空气中易吸收CO2D.它的阳离子的最外层
把一瓶不饱和的烧碱溶液分成三等份 保持温度不变 向三份溶液中分别加入一定量的NaOH Na2O2 N
把一瓶不饱和的烧碱溶液分成三等份,保持温度不变,向三份溶液中分别加入一定量的NaOH、Na2O2、Na2O,使溶液均恰好饱和。下列叙述不合理的是()A.加入
下图中A至F是化合物 G是单质。 写出A B E F的化学式:A____ B____ E__
下图中A至F是化合物,G是单质。写出A、B、E、F的化学式:A____, B____, E____, F____。
下列有关热稳定性的强弱比较 不正确的是( )A.Na2O2>Na2OB.NaHCO3<Na2CO3C
下列有关热稳定性的强弱比较,不正确的是()A.Na2O2>Na2OB.NaHCO3<Na2CO3C.KClO3>KClD.K2MnO4>KMnO4












