【物质结构与性质】(15分)(1)已知X Y Z为同一短周期的三种元素 其原子的部分电离能(kJ/m
| 【物质结构与性质】(15分) (1)已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ/mol)如下表所示:
②写出Y原子的电子排布式_____________ Y的第一电离能大于Z的第一电离能的原因_______________________ ③X晶体采用下列_________(填字母)堆积方式。 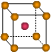 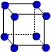 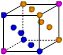 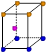 A B C D (2)N2O的等电子体为:①分子______________,②阴离子______________;由此可知N2O的中心原子的杂化类型为_____________。根据价层电子对互斥模型确定NO2的分子构型为:_____________________________________。 (3)已知铜能形成多种化合物,如硫酸铜的结构如下图所示, 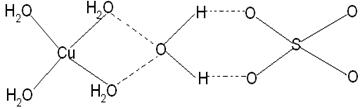 请在图中标出水合铜离子中的配位键. |
参考解答
| (1)①Z>Y>X ②1s22s22p63s2 ;Y元素原子最外层s轨道上的电子为全满③A (2)①CO2 ②SCN-或N3- ;SP 。V型 (3) 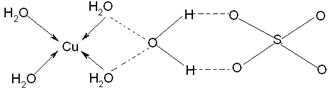 |
| (1)①根据元素的电离能可知X是第IA,Y是第ⅡA,Z是第ⅢA。所以金属性是X>Y>Z。金属性越强,电负性越小,所以三种元素电负性大小关系为Z>Y>X。 ②Y是镁,电子排布式为1s22s22p63s2。镁元素中3s轨道是全充满状态,稳定性强。 ③X是钠,采用体心立方堆积,A正确,B是简单立方堆积,C是面心立方堆积,D是六方最密堆积,答案选A。 (2)电子数和原子数分别都相等的是等电子体,所以和N2O互为等电子体的是CO2、SCN-或N3-。N2O中心氧原子含有的孤对电子是(6-3×2)÷2=0,所以氧原子是sp杂化。NO2分子中的N以两个sp2杂化轨道与氧原子成键,形成V字型的空间构型,此外分子中还形成一个三中心三电子大∏键. (3)水合铜离子中的配位键是由水分子提供孤对电子,铜离子提供空轨道,所以结构如图所示 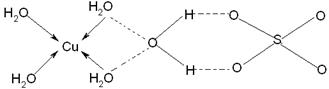 |
相似问题
氢元素与其他元素形成的二元化合物称为氢化物 下面关于氢化物的叙述正确的是( )
氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是()A.一个D2O分子所含的中子数为8B.NH3的结构式为H——HC.HCl的电子式为
下列说法中 正确的是( )A.键长越长 化学键越牢固B.成键原子间原子轨道重叠越少 共价键越牢
下列说法中,正确的是( )A.键长越长,化学键越牢固B.成键原子间原子轨道重叠越少,共价键越牢固C.对双原子分子来讲,键能越大,含有该键的分
下列各组微粒中不属于等电子体的是 A.CH4 NH4+B.H2S HClC.CO2 N2OD.CO3
下列各组微粒中不属于等电子体的是A.CH4、NH4+B.H2S、HClC.CO2、N2OD.CO32-、NO3-
(10分)A B C D E F六种物质在一定条件下有如下图所示的相互转化关系 所有反应物和生成物均
(10分)A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出。(1)若反应①、②、③均为溶液中的置换反应,
由A B元素组成的含4个原子核和42个电子的-2价阳离子中 1个A的核内质子数比B的核内质子数多8个
由A、B元素组成的含4个原子核和42个电子的-2价阳离子中,1个A的核内质子数比B的核内质子数多8个,试通过计算确定:(1)A、B元素名称分别为和。(2)写出












