Q R X Y Z为前20号元素中的五种 Q的低价氧化物与X单质分子的电子总数相等 R与Q同族 Y和
| Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子层结构相同且Y的原子序数小于Z。 (1)Q的最高价氧化物,其固态属于____________晶体,俗名为____________。 (2)R的氢化物分子的空间构型是____________;属于________分子(填“极性”或“非极性”)它与X形成的化合物可作为一种重要的陶瓷材料,其化学式是____________。 (3)X的常见氢化物的空间构型是____________;它的另一氢化物X2H4是一种火箭燃料的成分,其电子式是____________。 (4)Q分别与Y、Z形成的共价化合物的化学式是________________和________________;Q与Y形成的分子的电子式是____________,属于____________分子(填“极性”或“非极性”)。 |
参考解答
| (1)分子 干冰 (2)正四面体 非极性 Si3N4 (3)三角锥形 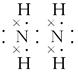 (4)CS2 CCl4 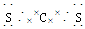 非极性 非极性 |
| 本题综合考查物质结构知识。根据题设条件可推知Q为C,R为Si,X为N,Y为S,Z为Cl。 (1)C的最高价氧化物为CO2,固态时是分子晶体,其俗名为干冰。 (2)Si的氢化物为SiH4,根据CH4的空间构型可知SiH4的空间构型为正四面体,SiH4分子中正负电荷重心重合,属于非极性分子。Si最外层有4个电子,N最外层有5个电子,它们形成化合物时,Si为+4价,N为-3价,其化学式为Si3N4。 (3)N的常见氢化物为NH3,其空间构型为三角锥形。根据N、H原子的成键原则,可得N2H4的结构简式为H2N—NH2,根据其结构简式可推写出其电子式。 (4)C与S可形成CS2,根据CO2的结构可写出CS2的电子式并知其为非极性分子。C与Cl形成CCl4分子。 |
相似问题
乙炔是有机合成工业的一种原料。工业上曾用与水反应生成乙炔。(1)互为等电子体 的电子式可表示为___
乙炔是有机合成工业的一种原料。工业上曾用与水反应生成乙炔。(1)互为等电子体,的电子式可表示为____________;1mol 中含有键的数目为_____________
在纳米级的空间中 水的结冰温度是怎样的呢?为此 科学家对不同直径碳纳米管中水的结冰温度进行分析。下图
在纳米级的空间中,水的结冰温度是怎样的呢?为此,科学家对不同直径碳纳米管中水的结冰温度进行分析。下图是四种不同直径碳纳米管中的冰柱结构及结冰温
下列说法中正确的是(NA为阿伏加德罗常数)( )A.28 g晶体硅中含有Si—Si键的个数为2NA
下列说法中正确的是(NA为阿伏加德罗常数)( )A.28 g晶体硅中含有Si—Si键的个数为2NAB.124 g白磷(P4)晶体中含有P—P键的个数为4NAC.12 g金刚石中含
[物质结构与性质](15分)下表为长式周期表的一部分 其中的序号代表对应的元素。①
[物质结构与性质](15分)下表为长式周期表的一部分,其中的序号代表对应的元素。①②③④⑤⑥⑦⑧⑨⑩(1)写出上表中元素⑨原子的外围电子排布式______
下列说法错误的是( )A.从CH4 NH4+ SO42-为正四面体结构 可推测PH4+ PO43-
下列说法错误的是( )A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构B.1mol金刚石晶体中,平均含有2molC-C键C.水的沸点












