(10分)有A B C D E F六种元素 已知:它们位于三个不同短周期 核电荷数依次增大;A与E
| (10分)有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物。 ⑴写出只含有A、B、D、E四种元素的两种常见无水盐的化学式_____________。 ⑵下图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示__________。E与D按原子个数比1﹕1形成的化合物的电子式为_____________________。 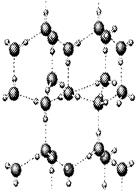 ⑶人们通常把拆开l mol某化学键所吸收的能量看成该 化学键的键能。键能的大小可以衡量化学键的强弱,也可以  用于估算化学反应的反应热(△H),化学反应的△H等于反应 用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和 的差。下表列出了上述部分元素形成的化学键的键能:
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质 ②试估算F单质晶体的燃烧热:____________________________________。 |
参考解答
(1)NaHCO3、CH3COONa (2)氢键 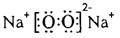 (3) ① a>c>b ②990.7 kJ/mol |
| 考查元素周期表的结构、晶体的判断及有关反应热的计算。 根据所给元素的性质可判断,A是H,B是C,C是N,D是O,E是Na,F是Si。 (1)只含有H、C、O、Na四种元素的两种常见无水盐分别为碳酸钠和醋酸钠。 (2)H和O形成的常见化合物是水,水中存在氢键,所以虚线表示氢键。Na和O按原子个数比1﹕1形成的化合物是过氧化钠,含有离子键和非极性键。 (3)①a是SiC属于原子晶体,b是CO2,是分子晶体,c是Si,也是原子晶体。因为Si-C的键能大于Si-Si的键能,所以碳化硅的熔点高于硅的,硅的高于CO2的,即a>c>b。 ②硅和氧气反应的化学方程式为Si+O2=SiO2,因为1个硅原子形成2个Si-Si,在二氧化硅晶体中1个硅原子形成4个Si-O,所以该反应的燃烧热是2×176 kJ·mol-1+497.3 kJ·mol-1-4×460 kJ·mol-1=990.7 kJ/mol。 |
相似问题
某晶体的一部分如图所示 这种晶体中A B C三种粒子数之比是 ( )。A.3∶9∶4
某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比是 ()。A.3∶9∶4B.1∶4∶2C.2∶9∶4D.3∶8∶4
下列不属于晶体特点的是A.有固定的几何外形B.一定有各向异性C.一定有固定的熔点D.一定是无色透明的
下列不属于晶体特点的是A.有固定的几何外形B.一定有各向异性C.一定有固定的熔点D.一定是无色透明的固体
如图是CaF2晶胞的结构。下列说法正确的是A.一个CaF2晶胞中含有8个Ca2+B.一个CaF2晶胞
如图是CaF2晶胞的结构。下列说法正确的是A.一个CaF2晶胞中含有8个Ca2+B.一个CaF2晶胞中含有8个F-C.在CaF2晶胞中Ca2+的配位数为4D.在CaF2晶胞中F-的配位数为8
(1) 已知在一定条件下的反应4HCl+O2=2Cl2 +2H2O中 有4mol HCl被氧化时
(1) 已知在一定条件下的反应4HCl+O2=2Cl2 +2H2O中, 有4mol HCl被氧化时,放出120kJ的热量,且则断开1 mol H—O 键与断开 1 mol H—Cl 键所需
下列叙述中正确的是A.晶体与非晶体的根本区别在于是否具有规则的几何外形B.晶体具有物理性质各向异性C
下列叙述中正确的是A.晶体与非晶体的根本区别在于是否具有规则的几何外形B.晶体具有物理性质各向异性C.晶体、非晶体均具有固定的熔点D.由玻璃制成规












