(1) 已知在一定条件下的反应4HCl+O2=2Cl2 +2H2O中 有4mol HCl被氧化时
(1) 已知在一定条件下的反应4HCl+O2=2Cl2 +2H2O中, 有4mol HCl被氧化时,放出120kJ的热量,且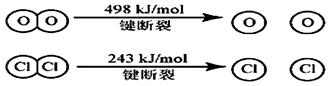 则断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差为__________KJ。 (2)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
(3)已知AlCl3熔点190℃,沸点183℃,结构如右图所示:AlCl3晶体内含有的作用力有 (填序号)。  A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F. 氢键 (4)氯和钾与不同价态的铜可生成两种化合物,这两种化合物中的阴离子均为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为 ,已知其中一种化合物的化学式为KCuCl3,另一种的化学式为 。 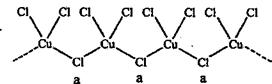 |
参考解答
| (1)33 (2)MgO> CaO> NaCl > KCl (3) B、D、E(漏一个扣1分,错选0分) (4)SP3 K2CuCl3 |
试题分析:(1)△H=断裂化学键吸收的能量-形成化学键放出的能量=4×x kJ/mol+498k J/mol-2×243kJ/mol-2×2×y kJ/mol=-120kJ/mol,解得y-x=33kJ/mol。 (2)离子半径Mg2+<Na+<O2-<Ca2+<Cl-;离子电荷数Na+=Cl-<O2-=Mg2+=Ca2+,离子晶体的离子半径越小,带电荷数越多,晶格能越大,则晶体的熔沸点越高,则NaCl、KCl、MgO、CaO熔点由高到低的顺序是MgO>CaO>NaCl>KCl。 (3)已知AlCl3熔点190℃,沸点183℃,这说明氯化铝的熔沸点很低,所以形成的晶体类型是分子晶体,根据结构可知,分子中含有的作用力有共价键、配位健和分子间作用力,答案选BDE。 (4)a位置上Cl原子成2个单键,含有2对孤对电子,杂化轨道数为4,所以杂化轨道类型为sp3。一种化合物的化学式为KCuCl3,其中铜元素为+2价,故另一种化合物中铜为+1价,CuCl3原子团的化合价为-2,其化学式为:K2CuCl3。 点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。 |
相似问题
下列叙述中正确的是A.晶体与非晶体的根本区别在于是否具有规则的几何外形B.晶体具有物理性质各向异性C
下列叙述中正确的是A.晶体与非晶体的根本区别在于是否具有规则的几何外形B.晶体具有物理性质各向异性C.晶体、非晶体均具有固定的熔点D.由玻璃制成规
(11分)下图分别为NaCl CsCl及金刚石的晶体结构模型。
(11分)下图分别为NaCl、CsCl及金刚石的晶体结构模型。⑴ 在NaCl晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+离子共有_____个。在一个NaCl
下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图 试判断NaCl晶体结构的图象是(
下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断NaCl晶体结构的图象是()A.(1)(3)B.(2)(3)C.(3)(4)D.只有( 4)
关于金属物理性质原因的描述不正确的是A.金属具有良好的导电性 是因为金属晶体中的“电子气”在电场作用
关于金属物理性质原因的描述不正确的是A.金属具有良好的导电性,是因为金属晶体中的“电子气”在电场作用下作定向移动B.金属具有良好的导热性能,是因
氮化碳是化工行业新合成的一种硬度比金刚石还大的晶体材料 已知在此化合物中各元素均处于其最高或最低价态
氮化碳是化工行业新合成的一种硬度比金刚石还大的晶体材料,已知在此化合物中各元素均处于其最高或最低价态,据此推断:(1)氮化碳的化学式可能是__ ___












