人类使用铜和它的合金具有悠久的历史 铜及其化合物在电子工业 材料工业 工农业生产及日常生活方面用途非
| 人类使用铜和它的合金具有悠久的历史,铜及其化合物在电子工业、材料工业、工农业生产及日常生活方面用途非常广泛。试回答下列问题。 (1)Cu+的核外电子排布式为 。 (2)铜镁合金是一种储氢材料,某种铜镁互化物晶胞结构如图,则该互化物的化学式为 。 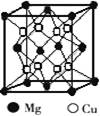 (3)叠氮化铜[Cu(N3)2]是一种紫黑色粉末,易爆炸,与N3-互为等电子体的分子有 (举2例)。 (4)丁炔铜是一种优良的催化剂,已知:CH≡CH+2HCHO 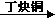 OHC-CH2CH2OH。 OHC-CH2CH2OH。OHC-CH2CH2OH中碳原子杂化方式有 ,乙炔属于 (填“极性”或“非极性”)分子。 (5)若向盛有CuSO4溶液的试管里加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,变成蓝色透明溶液,这时得到一种称为硫酸四氨合铜的物质,该物质的化学式为______________,其中含有的化学键类型有 。 |
参考解答
| (1)[Ar3d10或1s22s22p63s23p63d10(2分); (2)MgCu2(2分); (3)CO2、N2O 、CS2(2分); (4)sp2、sp3(2分);非极性(2分); (5)[Cu(NH3)4 SO4(2分);离子键、共价键(极性键)、配位键(3分); |
试题分析:(1)Cu是29号元素Cu+的核外电子数是28,所以Cu+的核外电子排布式为[Ar3d10或1s22s22p63s23p63d10 (2)根据晶胞结构的“均摊法”,顶点上的占晶胞的1/8,面心上的占晶胞的1/2,体内为1,所以晶胞中Mg原子的个数为8×1/8+6×1/2=4,Cu原子都在体内,个数是8,所以该互化物的化学式为MgCu2; (3)N3-是3原子16价电子的离子,与其互为等电子体的分子也是3原子16价电子的分子,有CO2、N2O、CS2; (4)有机物中碳原子的杂化方式依据碳原子周围的单键数,在OHC-CH2CH2OH中,碳原子周围有4个单键,则为sp3杂化,如-CH2CH2OH中的C;有3个单键则为sp2杂化,如OHC-;乙炔正负电荷重心重合,属于非极性分子; (5)硫酸四氨合铜的化学式为[Cu(NH3)4 SO4,SO42-与配离子之间是离子键,Cu2+与NH3之间是配位键,NH3分子中N、H之间是共价键。 |
相似问题
已知原子序数依次增大的A B C D E五种元素中有2种为非金属元素 其原子序数均小于30。其中A
已知原子序数依次增大的A、B、C、D、E五种元素中有2种为非金属元素,其原子序数均小于30。其中A、B、C、E的价电子层中均有2个未成对电子,A、B同族且可以
已知A B C D E F六种短周期元素的性质或结构信息如下表 请根据信息回答下列问题。元素性质或结
已知A、B、C、D、E、F六种短周期元素的性质或结构信息如下表,请根据信息回答下列问题。元素性质或结构信息A单质常温下为固体,难溶于水易于溶CS2。能形
(每空1分 共10分)根据已学知识 请你回答下列问题: (1)含有8个质子 10个中子的原子的化学符
(每空1分,共10分)根据已学知识,请你回答下列问题: (1)含有8个质子,10个中子的原子的化学符号__________。(2)最外层电子排布为4s24p1的原子的
A B C D4种元素 A单质在B单质中燃烧发出苍白色火焰 C单质跟A D形成化合物的水溶液反应生成
A,B,C,D4种元素,A单质在B单质中燃烧发出苍白色火焰,C单质跟A,D形成化合物的水溶液反应生成A单质,C原子与B原子的电子层结构相同,且最外层电子数之
X Y Z和W代表原子序数依次增大的4种短周期元素 它们满足以下条件:①元素周期表中Z与Y相邻 Z与
X,Y,Z和W代表原子序数依次增大的4种短周期元素,它们满足以下条件:①元素周期表中Z与Y相邻,Z与W也相邻; ②Y,Z和W3种元素的原子最外层电子数之和为












