(1)铬的外围电子排布式是 与铬同周期 最外层有3个未成对电子数的
| (1)铬的外围电子排布式是 ,与铬同周期,最外层有3个未成对电子数的主族元素名称是 ,该元素对应的最低价氢化物分子的中心原子采取了 杂化方式,分子的空间构型是 。 (2)富勒烯(C60)的结构如图,1molC60分子中σ键的数目为______ 。继C60后,科学家又合成了Si60、N60。请解释如下现象:熔点:Si60>N60>C60,而破坏分子所需要的能量: N60>C60>Si60,其原因是: 。 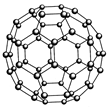 (3)氟化氢水溶液中存在氢键有 种。 (4)2011年诺贝尔化学奖授予了因发现准晶体材料的以色列科学家。某准晶体是锰与另一个短周期元素X形成的凝固态。已知:金属的电负性一般小于1.8。元素X与同周期相邻元素Y、Z的性质如下表:则X元素符号是 ,锰与X在准晶体中的结合力为 。 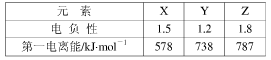 |
参考解答
| (1)3d54s1 砷 sp3 三角锥 (各1分,共4分) (2)90NA (2分) 组成、结构相似的分子晶体,相对分子质量越大,分子间作用力(或范德华力)越强,熔化所需的能量越多,故熔点:Si60>N60>C60(1分);而破坏分子所需断开化学键,元素电负性越强其所形成的化学键越稳定,或成键电子数越多,成键原子半径越小,断键所需能量越多,故破坏分析需要的能量顺序为N60>C60>Si60(1分)(合理答案均可,各1分,共2分) (3) 4 (2分) (4)Al (2分) 金属键 (1分) |
试题分析:(1)根据能量最低原理、洪特规则等规律,基态Cr原子外围电子排布式为3d54s1;价电子排布式为4s24p3的As符合要求,即砷;PH3中P采取sp3杂化方式,孤对电子与成键电子对形成正四面体形,则PH3分子为三角锥形;(2)读图可知,每个碳原子周围形成3个C—C键,每个C—C键被相邻2个碳原子共用,则1个碳原子可形成1.5个σ键,60个碳原子可形成90个σ键,1molC60分子含有90NA个σ键;组成、结构相似的分子晶体,相对分子质量越大,分子间作用力(或范德华力)越强,熔化所需的能量越多,故熔点:Si60>N60>C60;破坏分子所需断开化学键,元素电负性越强其所形成的化学键越稳定,或成键电子数越多,成键原子半径越小,断键所需能量越多,故破坏分析需要的能量顺序为N60>C60>Si60;(3)氟化氢水溶液中存在的氢键有F—H……F、F—H……O、O—H……F、O—H……O四种类型;(4)由表中信息可知X是铝,锰与铝以金属键结合。 |
相似问题
有原子序数依次增大的A B C D E五种元素 A是短周期中族序数等于周期数的非金属元素;B元素的原
有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去,也不易得到电子,其基态原子每种轨道中
A B D是三种常见的短周期元素 它们的原子序数逐渐增大 B元素原子最外层电子数3个 是D元素原子最
A、B、D是三种常见的短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数3个,是D元素原子最外层电子数的一半,A元素原子最外层电子数比B多一个
A B C D四种均为短周期元素 原子序数依次增大(1)A元素原子最外层电子数是核外电子层数的3倍
A、B、C、D四种均为短周期元素,原子序数依次增大(1)A元素原子最外层电子数是核外电子层数的3倍,A与D同主族,A和D可形成两种化合物X和Y,X和水反应后
已知X Y Z都是短周期的元素 它们的原子序数依次递增。X原子的电子层数与它的核外电子总数相同 而Z
已知X,Y,Z都是短周期的元素,它们的原子序数依次递增。X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层 的3倍,Y和Z可以形成2
石榴石是石榴石族矿物的总称 颜色随成分的不同而变化 其组成可以表示为A3B2(SiO4)3 式中A
石榴石是石榴石族矿物的总称,颜色随成分的不同而变化,其组成可以表示为A3B2(SiO4)3,式中A、B均 为金属元素,则A、B对应的化合价依次为[ ]A +2,+3












