元素周期表第ⅤA族元素包括氮 磷 砷(As) 锑(Sb)等。这些元素无论在研制新型材料 还是在制作传
| 元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等。这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用。请回答下列问题: (1)N4分子是一种不稳定的多氮分子,这种物质分解后能产生无毒的氮气并释放出大量能量,能被应用于制造推进剂或炸药。N4是由四个氮原子组成的氮单质,其中氮原子采用的轨道杂化方式为sp3,该分子的空间构型为________,N—N键的键角为________。 (2)基态砷原子的最外层电子排布式为________。 (3)电负性是用来表示两个不同原子形成化学键时吸引键合电子能力的相对强弱,是元素的原子在分子中吸引共用电子对的能力。由此判断N、P、As、Sb的电负性从大到小的顺序是______________。 (4)联氨(N2H4)可以表示为H2N—NH2,其中氮原子采用的轨道杂化方式为________,联氨的碱性比氨的碱性________(填“强”或“弱”),其原因是________________________________________________________________。 写出N2H4与N2O4反应的化学方程式:____________________。 (5)元素X与N同周期,且X的原子半径是该周期主族元素原子半径中最小的,X与Ca形成的化合物CaX2的晶胞结构如图所示: 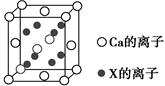 CaX2的晶体类型是________,一个晶胞中含有Ca的离子数为________,含有X的离子数为________。 |
参考解答
| (1)正四面体 60° (2)4s24p3 (3)N>P>As>Sb (4)sp3 弱 N2H4中的N原子上电子云密度小于NH3,更难结合H+ 2N2H4+N2O4=3N2+4H2O (5)离子晶体 4 8 |
(1)N4中氮原子的轨道杂化方式为sp3,其空间构型可参照P4(白磷),应为正四面体结构,N—N键的键角为60°;(2)砷位于第四周期ⅤA族,其最外层电子排布式为4s24p3;(3)同主族元素从上到下,元素的电负性逐渐减小;(4)联氨(HN2—NH2)中氮原子与其他原子结合形成三个σ键,还有一对孤电子对,其轨道杂化方式为sp3;与NH3相比,N2H4碱性弱,因为N2H4相当于NH3的一个H原子换成了—NH2,N原子的吸电子能力远强于H原子,因此N2H4中的N原子上电子云密度小于NH3,更难结合H+;(5)N元素位于第二周期,该周期中原子半径最小的主族元素为F,CaF2为离子晶体,该晶胞中Ca2+的个数为8×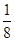 +6× +6×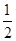 =4,F-均在晶胞内部,故为8个。 =4,F-均在晶胞内部,故为8个。 |
相似问题
(1)铬的外围电子排布式是 与铬同周期 最外层有3个未成对电子数的
(1)铬的外围电子排布式是,与铬同周期,最外层有3个未成对电子数的主族元素名称是,该元素对应的最低价氢化物分子的中心原子采取了杂化方式,分子的空
有原子序数依次增大的A B C D E五种元素 A是短周期中族序数等于周期数的非金属元素;B元素的原
有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去,也不易得到电子,其基态原子每种轨道中
A B D是三种常见的短周期元素 它们的原子序数逐渐增大 B元素原子最外层电子数3个 是D元素原子最
A、B、D是三种常见的短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数3个,是D元素原子最外层电子数的一半,A元素原子最外层电子数比B多一个
A B C D四种均为短周期元素 原子序数依次增大(1)A元素原子最外层电子数是核外电子层数的3倍
A、B、C、D四种均为短周期元素,原子序数依次增大(1)A元素原子最外层电子数是核外电子层数的3倍,A与D同主族,A和D可形成两种化合物X和Y,X和水反应后
已知X Y Z都是短周期的元素 它们的原子序数依次递增。X原子的电子层数与它的核外电子总数相同 而Z
已知X,Y,Z都是短周期的元素,它们的原子序数依次递增。X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层 的3倍,Y和Z可以形成2












