资料显示:在一定条件下黄铵铁钒在pH=0.5~2.5范围内均能稳定存在 工业上用酸浸法制取硫酸铜的流
资料显示:在一定条件下黄铵铁钒在pH=0.5~2.5范围内均能稳定存在,工业上用酸浸法制取硫酸铜的流程示意图如下: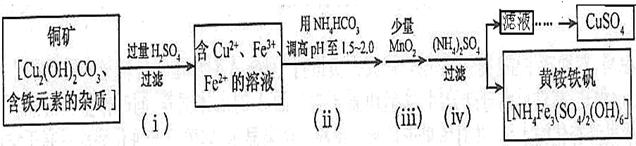 根据题意完成下列问题: (1)步骤(ii)所加试剂起调节pH作用的离子是 (填离子符号)。 (2)在步骤(iii)发生的反应中,加入少量MnO2的作用是 (3)步骤(iv)除去杂质的离子方程式可表示为 (4)实验室模拟碱式碳酸铜[Cu2(OH)2CO3]的制备,向大试管中加入碳酸钠溶液和硫酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。根据上述碱式碳酸铜的制备方法,请完成以下问题: ①过滤后洗涤的目的是什么 ;简述如何洗涤沉淀 ②若实验得到a g样品(只含CuO杂质),取此样品加热至分解完全后,得到b g固体,此样品中碱式碳酸铜的质量分数是 |
参考解答
| (14分) (1)HCO3-(2分) (2)将溶液中Fe2+转变为Fe3+ (2分) (3) 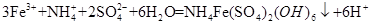 (3分) (3分)(4)①除去沉淀表面吸附的Na+和SO42-(2分);沿着玻璃棒向漏斗中加蒸馏水至刚好浸没沉淀,让蒸馏水流尽后,重复2~3次即可。(2分) ② 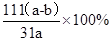 (3分) (3分) |
试题分析: (1)流程图中可以看出铜矿在过量硫酸的作用下溶解,溶液呈强酸性,NH4HCO3中HCO3-+H+=CO2+H2O; (2)根据工艺流程图中可以看出黄铵铁钒中为Fe3+,在ⅱ、ⅲ、ⅳ中一定有氧化剂,故MnO2将溶液中Fe2+转变为Fe3+; (3)从ⅳ溶液离子和产物分析得到 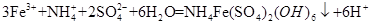 ; ;(4)结合题中信息,①洗涤的目的是除去沉淀表面吸附的Na+和SO42-。 ②设Cu2(OH)2CO3质量为Xg, Cu2(OH)2CO3  2CuO+CO2↑+H2O↑,由差量法可得 2CuO+CO2↑+H2O↑,由差量法可得222g △m=62g Xg (a-b)g Xg= 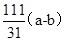 g,此样品中碱式碳酸铜的质量分数是 g,此样品中碱式碳酸铜的质量分数是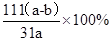 。 。 |
相似问题
目前世界各国获得镁的主要来源从海水中提取 以下是提取镁的过程中涉及到的几种物质常温下的溶度积常数 根
目前世界各国获得镁的主要来源从海水中提取,以下是提取镁的过程中涉及到的几种物质常温下的溶度积常数,根据你所学的知识回答下面的几个问题:物质CaC
请选用适当的试剂和分离装置除去下列物质中所含的杂质(括号内为杂质) 将所选的试剂及装置的编号填入表中
请选用适当的试剂和分离装置除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及装置的编号填入表中。试剂:a.水 b.NaOH溶液 c.溴的CCl4溶液
下列各组物质的分离或提纯 应选用下述方法的哪一种?(填序号)A.分液B.过滤C.萃取D.蒸馏 E 结
下列各组物质的分离或提纯,应选用下述方法的哪一种?(填序号)A.分液B.过滤C.萃取D.蒸馏 E、结晶 F、加热分解(1)除去Ca(OH)2溶液中悬浮的 CaC
焰色反应可用来检验A.所有元素的存在B.所有金属单质的存在C.某些金属单质或金属离子的存在D.所有非
焰色反应可用来检验A.所有元素的存在B.所有金属单质的存在C.某些金属单质或金属离子的存在D.所有非金属元素的存在
对于混合物的分离或提纯 常采用的方法有:①过滤 ②蒸发 ③蒸馏 ④分液 下列各组混合物的分离或提纯应
对于混合物的分离或提纯,常采用的方法有:①过滤,②蒸发,③蒸馏,④分液,下列各组混合物的分离或提纯应采用什么方法?(要求:填序号)(1)________分离












