目前世界各国获得镁的主要来源从海水中提取 以下是提取镁的过程中涉及到的几种物质常温下的溶度积常数 根
目前世界各国获得镁的主要来源 从海水中提取,以下是提取镁的过程中涉及到的几种物质常温下的溶度积常数,根据你所学的知识回答下面的几个问题: 从海水中提取,以下是提取镁的过程中涉及到的几种物质常温下的溶度积常数,根据你所学的知识回答下面的几个问题:
(2)已知某地海水中的镁离子的浓度为1.8×10-3 mol·L-1,则常温下要使镁离子产生沉淀,溶液pH最低应为 。 (3)实验室中常用CaCO3制CO2,其产物之一的氯化钙是应用广泛的化学试剂,可作干燥剂、冷冻剂等。为了测定某氯化钙样品中钙元素的含量,进行如下实验: (I)准确称取氯化钙样品0.2000g,放入烧杯中,加入适量6mol/L的盐酸和适量蒸馏水使样品完全溶解,再加入35mL 0.25mol/L (NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀,经检验,Ca2+已沉淀完全。 (II)过滤并洗涤(I)所得沉淀。 (III)加入足量的10% H2SO4溶液和适量的蒸馏水,(II)中沉淀完全溶解,溶液呈酸性,加热至75℃,趁热逐滴加入0.05000 mol/L KMnO4溶液16.00mL,恰好完全反应。请回答: 已知滴定过程发生的反应为2MnO4- + 5H2C2O4 + 6H+ ="=2" Mn2+ +10 CO2↑+8 H2O(已配平) ①0.05000 mol/L KMnO4溶液标准溶液应置于 (选填“酸式”或“碱式”)滴定管中。 ②滴定终点的现象为 。 ③该氯化钙样品中钙元素的质量百分数为 。 |
参考解答
(12分)(1)不能(1分)贝壳研磨成粉末仍是CaCO3,由于CaCO3比MgCO3还要难溶,所以将其直接投入海水中不能产生MgCO3(2分);CaCO3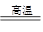 CaO+CO2↑(2分,条件写△,不扣分) CaO+CO2↑(2分,条件写△,不扣分)(2)10(2分)(3)①酸式(1分) ②溶液由无色变成紫色,且半分钟内不退去(2分) ③40%(2分) |
试题分析:(1)贝壳研磨成粉末仍是CaCO3,由于CaCO3比MgCO3还要难溶,所以将其直接投入海水中不能产生MgCO3,所以不能通过将贝壳研磨成粉末直接投入海水里制备含镁的沉淀。碳酸钙加热分解生成的氧化钙,能溶于水生成氢氧化钙,从而生成氢氧化镁沉淀,反应的化学方程式是CaCO3 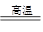 CaO+CO2↑。 CaO+CO2↑。(2)已知氢氧化镁的溶度积常数是1.8×10-11,则常温下要使镁离子产生沉淀时OH-的浓度应该是 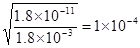 ,所以溶液pH最低应为10。 ,所以溶液pH最低应为10。(3)①高锰酸钾溶液具有强氧化性,能腐蚀橡胶,且需要用稀硫酸酸化,所以KMnO4溶液标准溶液应置于酸式滴定管中。 ②应用酸性高锰酸钾溶液自身显紫红色,所以滴定终点时的现象是溶液由无色变成紫色,且半分钟内不退去。 ③根据2MnO4- + 5H2C2O4 + 6H+ ='=2' Mn2+ +10 CO2↑+8 H2O可知,草酸的物质的量是0.05000 mol/L×0.016L×2.5=0.002mol,则草酸钙的物质的量也是0.002mol,所以该氯化钙样品中钙元素的质量百分数为 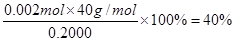 。 。点评:该题是中等难度的试题,试题贴近高考,难度较大,注重能力的培养。该题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。 |
相似问题
请选用适当的试剂和分离装置除去下列物质中所含的杂质(括号内为杂质) 将所选的试剂及装置的编号填入表中
请选用适当的试剂和分离装置除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及装置的编号填入表中。试剂:a.水 b.NaOH溶液 c.溴的CCl4溶液
下列各组物质的分离或提纯 应选用下述方法的哪一种?(填序号)A.分液B.过滤C.萃取D.蒸馏 E 结
下列各组物质的分离或提纯,应选用下述方法的哪一种?(填序号)A.分液B.过滤C.萃取D.蒸馏 E、结晶 F、加热分解(1)除去Ca(OH)2溶液中悬浮的 CaC
焰色反应可用来检验A.所有元素的存在B.所有金属单质的存在C.某些金属单质或金属离子的存在D.所有非
焰色反应可用来检验A.所有元素的存在B.所有金属单质的存在C.某些金属单质或金属离子的存在D.所有非金属元素的存在
对于混合物的分离或提纯 常采用的方法有:①过滤 ②蒸发 ③蒸馏 ④分液 下列各组混合物的分离或提纯应
对于混合物的分离或提纯,常采用的方法有:①过滤,②蒸发,③蒸馏,④分液,下列各组混合物的分离或提纯应采用什么方法?(要求:填序号)(1)________分离
用下列装置进行相应实验 能达到目的的是A.用图1装置除去C12中少量的HClB.用图2装置蒸干NH4
用下列装置进行相应实验,能达到目的的是A.用图1装置除去C12中少量的HClB.用图2装置蒸干NH4Cl饱和溶液制取NH4Cl晶体C.用图3装置制取纯净的CO2气体D.












