①在第一系列过渡元素二价离子的水合热中 为什么Ni2+的水合热最大?②判定配合物热力学稳定性次序d4
①在第一系列过渡元素二价离子的水合热中,为什么Ni2+的水合热最大?②判定配合物热力学稳定性次序d4>d5>d6是否正确。
请帮忙给出正确答案和分析,谢谢!
参考解答
正确答案:①二价金属离子从气态溶于水中所产生的热量称为水合热可表示为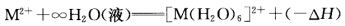 从Ca2+到Zn2+d电子构型是d0~d10。由于核电荷增加3d电子壳层缩小带极性的水分子和离子间距减小水化作用增大水合热理应循序上升得到一条平滑的直线但水合热的实验值如表6—3所示。
从Ca2+到Zn2+d电子构型是d0~d10。由于核电荷增加3d电子壳层缩小带极性的水分子和离子间距减小水化作用增大水合热理应循序上升得到一条平滑的直线但水合热的实验值如表6—3所示。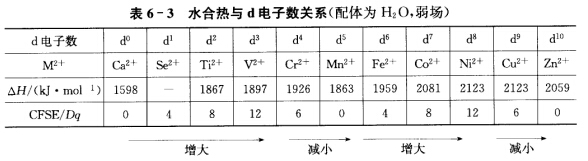 这种变化规律原因如下:Ca2+、Mn2+、Zn2+具有d0、d5和d10构型CFSE为0。d1~3。在八面体场中进入t2g轨道CFSE依次增大水合热也随之增大即水合热除了因有效核电荷增大而增大外还因额外有CFSE。而d4~5电子因进入高能量eg轨道CFSE减少水合热随之而减小。d6~8电子再次填入低能量的t2g轨道CFSE增大水合热上升。d9~10最后两个电子填人高能量的eg轨道CFSE下降水合热下降。Ni2+d8CFSE最大因此相应的水合热也最大。 ②由表6—3可知该次序是错误的。
这种变化规律原因如下:Ca2+、Mn2+、Zn2+具有d0、d5和d10构型CFSE为0。d1~3。在八面体场中进入t2g轨道CFSE依次增大水合热也随之增大即水合热除了因有效核电荷增大而增大外还因额外有CFSE。而d4~5电子因进入高能量eg轨道CFSE减少水合热随之而减小。d6~8电子再次填入低能量的t2g轨道CFSE增大水合热上升。d9~10最后两个电子填人高能量的eg轨道CFSE下降水合热下降。Ni2+d8CFSE最大因此相应的水合热也最大。 ②由表6—3可知该次序是错误的。
①二价金属离子从气态溶于水中所产生的热量称为水合热,可表示为从Ca2+到Zn2+,d电子构型是d0~d10。由于核电荷增加,3d电子壳层缩小,带极性的水分子和离子间距减小,水化作用增大,水合热理应循序上升,得到一条平滑的直线,但水合热的实验值如表6—3所示。这种变化规律原因如下:Ca2+、Mn2+、Zn2+具有d0、d5和d10构型,CFSE为0。d1~3。在八面体场中进入t2g轨道,CFSE依次增大,水合热也随之增大,即水合热除了因有效核电荷增大而增大外,还因额外有CFSE。而d4~5电子因进入高能量eg轨道,CFSE减少,水合热随之而减小。d6~8电子再次填入低能量的t2g轨道,CFSE增大,水合热上升。d9~10最后两个电子填人高能量的eg轨道,CFSE下降,水合热下降。Ni2+d8,CFSE最大,因此相应的水合热也最大。②由表6—3可知该次序是错误的。
相似问题
Ni(PCl3)4 Pd(PR3)4等零价金属配合物是怎样成键的?请帮忙给出正确答案和分析 谢谢!
Ni(PCl3)4、Pd(PR3)4等零价金属配合物是怎样成键的?请帮忙给出正确答案和分析,谢谢!
O3分子的键角为116.8° 中心原子采取sp2不等性杂化 若用杂化轨道∮=c1∮2s+c2∮2p描
O3分子的键角为116.8°,中心原子采取sp2不等性杂化,若用杂化轨道∮=c1∮2s+c2∮2p描述中心原子的杂化,试求成键杂化轨道中的c2和c2值。请帮忙给出正
下列光谱项不属于p1d1组态的是( )。A.1PB.1DC.1SD.3F请帮忙给出正确答案和分析 谢
下列光谱项不属于p1d1组态的是( )。A.1PB.1DC.1SD.3F请帮忙给出正确答案和分析,谢谢!
计算C2H2Cl2的三种异构体的偶极矩。 请帮忙给出正确答案和分析 谢谢!
计算C2H2Cl2的三种异构体的偶极矩。 请帮忙给出正确答案和分析,谢谢!
同核双原子分子是没有极性的 下列同核多原子分子中有极性的是( )。A.I3-B.N3C.O3D.P4
同核双原子分子是没有极性的,下列同核多原子分子中有极性的是( )。A.I3-B.N3C.O3D.P4请帮忙给出正确答案和分析,谢谢!












