N2的三个最高占有轨道电子电离的UPS谱带所对应的电离能分别为14.01eV 16.53eV和19.
N2的三个最高占有轨道电子电离的UPS谱带所对应的电离能分别为14.01eV、16.53eV和19.6eV(图7—19),试说明N2的电子组态。 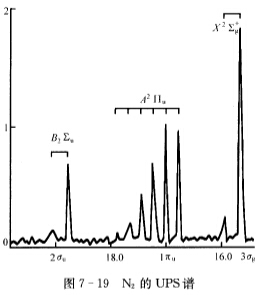
请帮忙给出正确答案和分析,谢谢!
参考解答
正确答案:早先根据简单分子轨道理论以为N2的结构为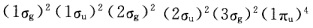 20世纪60年代光电子能谱技术问世以后上述结构不能解释N2的光电子能谱。图7—19中三个谱带是N2中三个最高占有轨道中电子电离形成的。从峰形可以判断只有中间一个谱带对应的是典型的化学键中电子的电离而Ⅰ、Ⅲ谱带窄而简单对应的应该是弱化学键或非键轨道决不可能是典型的化学键。这就是说在2σu、3σg、1πu三个最高占有轨道中仅有一个是典型的化学键轨道。这就促使人们进一步研究发现由于N原子的2s和2p轨道相互作用使3σg和1πu能级颠倒N2排布为
20世纪60年代光电子能谱技术问世以后上述结构不能解释N2的光电子能谱。图7—19中三个谱带是N2中三个最高占有轨道中电子电离形成的。从峰形可以判断只有中间一个谱带对应的是典型的化学键中电子的电离而Ⅰ、Ⅲ谱带窄而简单对应的应该是弱化学键或非键轨道决不可能是典型的化学键。这就是说在2σu、3σg、1πu三个最高占有轨道中仅有一个是典型的化学键轨道。这就促使人们进一步研究发现由于N原子的2s和2p轨道相互作用使3σg和1πu能级颠倒N2排布为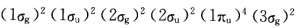 其中三个最高占有轨道3σg、1πu、2σu分别为弱成键、强成键和弱反键轨道。这里需要说明的是从峰形只能判定它是否是典型的化学键但不能确定是成键轨道还是反键轨道。可利用分子振动光谱的数据比较中性分子与分子离子的振动频率反键电子电离导致v增大成键电子电离导致v减少从v的变化可确定是成键轨道还是反键轨道。
其中三个最高占有轨道3σg、1πu、2σu分别为弱成键、强成键和弱反键轨道。这里需要说明的是从峰形只能判定它是否是典型的化学键但不能确定是成键轨道还是反键轨道。可利用分子振动光谱的数据比较中性分子与分子离子的振动频率反键电子电离导致v增大成键电子电离导致v减少从v的变化可确定是成键轨道还是反键轨道。
早先根据简单分子轨道理论,以为N2的结构为,20世纪60年代光电子能谱技术问世以后,上述结构不能解释N2的光电子能谱。图7—19中三个谱带是N2中三个最高占有轨道中电子电离形成的。从峰形可以判断,只有中间一个谱带对应的是典型的化学键中电子的电离,而Ⅰ、Ⅲ谱带窄而简单,对应的应该是弱化学键或非键轨道,决不可能是典型的化学键。这就是说在2σu、3σg、1πu三个最高占有轨道中,仅有一个是典型的化学键轨道。这就促使人们进一步研究,发现由于N原子的2s和2p轨道相互作用使3σg和1πu能级颠倒,N2排布为,其中三个最高占有轨道3σg、1πu、2σu分别为弱成键、强成键和弱反键轨道。这里需要说明的是,从峰形只能判定它是否是典型的化学键,但不能确定是成键轨道还是反键轨道。可利用分子振动光谱的数据,比较中性分子与分子离子的振动频率,反键电子电离导致v增大,成键电子电离导致v减少,从v的变化可确定是成键轨道还是反键轨道。
相似问题
某一立方晶系AB型金属氧化物 密度为3.581×103kg.m-3。今用波长为0.154nm的X射线
某一立方晶系AB型金属氧化物,密度为3.581×103kg m-3。今用波长为0.154nm的X射线测得在2θ为36.976°、42.944°、62.36°、74.746°、78.686°、
已知一个折射平面 其物方折射率n=1;像方折射率n=1.5 当物距L=-100mm 物方孔径角U=-
已知一个折射平面,其物方折射率n=1;像方折射率n=1.5,当物距L=-100mm,物方孔径角U=-5°时,试求其像距L。请帮忙给出正确答案和分析,谢谢!
常用晶格能来表示_______键的强弱 用偶极距来量度_______极性的大小。请帮忙给出正确答案和
常用晶格能来表示_______键的强弱,用偶极距来量度_______极性的大小。请帮忙给出正确答案和分析,谢谢!
证明在底心结构中 衍射线的强度不受指标l的影响。请帮忙给出正确答案和分析 谢谢!
证明在底心结构中,衍射线的强度不受指标l的影响。请帮忙给出正确答案和分析,谢谢!
写出一组(110)面的1级 3级衍射的布拉格方程。请帮忙给出正确答案和分析 谢谢!
写出一组(110)面的1级、3级衍射的布拉格方程。请帮忙给出正确答案和分析,谢谢!












