某一立方晶系AB型金属氧化物 密度为3.581×103kg.m-3。今用波长为0.154nm的X射线
某一立方晶系AB型金属氧化物,密度为3.581×103kg.m-3。今用波长为0.154nm的X射线测得在2θ为36.976°、42.944°、62.36°、74.746°、78.686°、94.09。、105.806。、109.86。处有衍射峰,①该氧化物为何种点阵型式?②晶胞参数是多少?晶胞中的结构基元有几个?③金属原子占据何种空隙(正、负离子半径比为0.429)?④氧原子以何种方式堆积?⑤金属原子的相对原子质量是多少?⑥金属离子占据该种空隙的分数是多少?
请帮忙给出正确答案和分析,谢谢!
参考解答
正确答案:①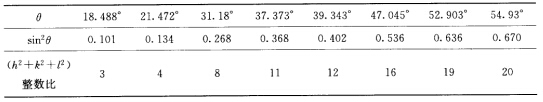 可知该AB型金属氧化物是立方面心点阵。 ②θ1所对应的衍射指标为111则
可知该AB型金属氧化物是立方面心点阵。 ②θ1所对应的衍射指标为111则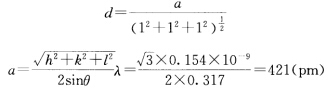 品胞中有4个结构基元(每个结构基元为AB)。 ③由正、负离子比值可知配位数为6所以金属原子占据氧原子堆成的八面体空隙中。 ④氧原子作A1堆积即立方最密堆积。 ⑤M=
品胞中有4个结构基元(每个结构基元为AB)。 ③由正、负离子比值可知配位数为6所以金属原子占据氧原子堆成的八面体空隙中。 ④氧原子作A1堆积即立方最密堆积。 ⑤M=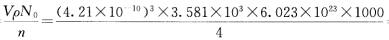 =40.23 金属原子的相对原子质量为40.23-16=24.23。 ⑥氧原子数与正八面体空隙数之比是1:1对于AB型氧化物金属离子占据了所有的八面体空隙。
=40.23 金属原子的相对原子质量为40.23-16=24.23。 ⑥氧原子数与正八面体空隙数之比是1:1对于AB型氧化物金属离子占据了所有的八面体空隙。
①可知该AB型金属氧化物是立方面心点阵。②θ1所对应的衍射指标为111,则品胞中有4个结构基元(每个结构基元为AB)。③由正、负离子比值可知配位数为6,所以金属原子占据氧原子堆成的八面体空隙中。④氧原子作A1堆积即立方最密堆积。⑤M==40.23金属原子的相对原子质量为40.23-16=24.23。⑥氧原子数与正八面体空隙数之比是1:1,对于AB型氧化物,金属离子占据了所有的八面体空隙。
相似问题
已知一个折射平面 其物方折射率n=1;像方折射率n=1.5 当物距L=-100mm 物方孔径角U=-
已知一个折射平面,其物方折射率n=1;像方折射率n=1.5,当物距L=-100mm,物方孔径角U=-5°时,试求其像距L。请帮忙给出正确答案和分析,谢谢!
常用晶格能来表示_______键的强弱 用偶极距来量度_______极性的大小。请帮忙给出正确答案和
常用晶格能来表示_______键的强弱,用偶极距来量度_______极性的大小。请帮忙给出正确答案和分析,谢谢!
证明在底心结构中 衍射线的强度不受指标l的影响。请帮忙给出正确答案和分析 谢谢!
证明在底心结构中,衍射线的强度不受指标l的影响。请帮忙给出正确答案和分析,谢谢!
写出一组(110)面的1级 3级衍射的布拉格方程。请帮忙给出正确答案和分析 谢谢!
写出一组(110)面的1级、3级衍射的布拉格方程。请帮忙给出正确答案和分析,谢谢!
具有六方ZnS型晶体结构的SiC晶体的六方晶胞参数为a=308pm c=505pm C原子的分数坐标
具有六方ZnS型晶体结构的SiC晶体的六方晶胞参数为a=308pm,c=505pm,C原子的分数坐标为(0,0,0)、(),Si原子的分数坐标为(0,0,)、(),请回答下列问












